۱. معرفی
همهگیری کووید-۱۹ تا سپتامبر ۲۰۲۰ منجر به ابتلای بیش از ۲۸.۷ میلیون مورد و ۹۲۰.۸۴۷ مرگ در سراسر جهان شده است. حدود ۱۵٪ از بزرگسالان آلوده به ذاتالریه شدید مبتلا میشوند که نیاز به اکسیژن مکمل دارند و ۵٪ آنها به سمت سندرم زجر تنفسی حاد (ARDS) پیشرفت میکنند که اغلب برای چندین هفته به تهویه مکانیکی نیاز دارند.
اقدامات حمایتی همچون سنگ بنای درمان COVID-19 در غیاب درمانهای خاص است. مزایای بیولوژیکی بالقوه اتوهمتراپی اوزون دار شامل کاهش هیپوکسی بافتی، کاهش افزایش انعقاد پذیری، تعدیل عملکرد ایمنی با مهار واسطه های التهابی، بهبود عملکرد فاگوسیتیک و ایجاد اختلال در تکثیر ویروسی است.
ازن ممکن است گردش خون و اکسیژن رسانی به بافت ایسکمیک را در نتیجه اثر هماهنگ اکسید نیتریک، افزایش سطح ۲،۳-DPG داخل اریتروسیتی و افزایش برخی پروستاسیکلین ها مانند PGI2 بهبود بخشد. این اثرات می تواند به کاهش بیش از حد انعقاد که در بیماران COVID-19 مشاهده شده است کمک کند. نقش مهم دیگری که ازن در COVID-19 ایفا می کند، اثرات تعدیل کننده ایمنی آن است. پاسخ التهابی مشخصه عفونت شدید است و تعدیل سازی سیتوکین کلیدی برای جلوگیری از وخامت بیمار است. ازن قادر به تعدیل و کنترل سیتوکینهایی است که سیتوکینهای ضد التهابی آزاد میکنند و فعالیتهای التهابی مانند تولید IL-1، IL-6 و TNF-α را کاهش میدهد و با حالت التهاب بیش از حد که در بیماران مبتلا به کووید دیده میشود مقابله میکند، اما علاوه بر این، ازن دارای خواص ضدالتهابی قوی از طریق تعدیل NLRP3 نیز میباشد. التهاب در بیماری های مختلف اوزون همچنین ممکن است تجمع نوتروفیل ها را به صورت موضعی تعدیل کند، بیان IL-6، TNF-α و آلبومین اصلاح شده ناشی از ایسکمی در کلیه ها را تعدیل کند و همچنین ظرفیت آنتی اکسیدانی موضعی را افزایش دهد.
اوزون تراپی عبارت است از تجویز مخلوطی از گاز ۹۷ درصد اکسیژن و ۳ درصد ازن تولید شده از یک ژنراتور ازن پزشکی. اوزون مولکولی است که از سه اتم اکسیژن تشکیل شده است که همگی الکترون های مشابهی دارند. از آنجا که الکترون کافی برای دور زدن وجود ندارد، ازن یک مولکول نسبتا ناپایدار است. این ناپایداری دلیلی است برای این که اوزون یک محرک بیولوژیکی قوی باشد. اوزونتراپی را میتوان با افزودن آن به نمونهای از نمونه خون خود بیمار و سپس انفوزیون مجدد آن بهصورت سیستمی اجرا کرد که به آن «اتوهموتراپی ازندار» میگویند.
ازن یک گاز طبیعی است که از اتم های اکسیژن تولید می شود. تک اتم های اکسیژن نمی توانند به تنهایی بدون گروه بندی مجدد در آرایش مولکول های اکسیژن دو اتمی دوام بیاورند. در این مرحله نوترکیبی، برخی از اتمها به اکسیژن سه اتمی آزاد تبدیل میشوند. این مولکول سه اکسیژنه جدید اوزون نامیده میشود که در استراتوسفر نیز یافت میشود، جایی که پرتوهای فرابنفش مختلف را برای محافظت از ما جذب میکند. وزن مولکولی آن ۴۸ گرم در مول با حلالیت در آب ۰.۵۷ گرم در لیتر در دمای ۲۰ درجه سانتی گراد (حدود ده برابر بیشتر از اکسیژن) است. در نتیجه، حلالیت زیاد ازن در آب باعث می شود تا واکنش فوری آن با هر ترکیب محلول و بیومولکول موجود در مایعات بیولوژیکی انجام شود.
ازن توسط دستگاه های پزشکی برای اهداف پزشکی تولید می شود. ازن پزشکی از اکسیژن خالص با عبور دادن آن از یک گرادیان ولتاژ بالا (۵-۱۳ KV) به دست می آید. این مخلوط گازی متشکل از ۹۷ درصد اکسیژن و بیش از ۳ درصد ازن تولید می کند. از نظر ترمودینامیکی ناپایدار است و خود به خود به اکسیژن باز می گردد. غلظت های بین ۱۰ تا ۷۰ میکروگرم در میلی لیتر معمولاً برای اهداف پزشکی استفاده می شود. راه های متعددی برای تجویز ازن پزشکی وجود دارد. مسیر استنشاق ممکن است برای سیستم ریوی و سایر اندام ها سمی باشد. با این حال، اتوهموتراپی ازن دار در چندین آزمایش بالینی تصادفی، مطالعات مشاهده ای و متاآنالیز بی خطر نشان داده شده است. بروز عوارض جانبی اوزون تراپی بسیار کم است (۰۰۰۷/۰ درصد تخمین زده می شود) و معمولاً به صورت سرخوشی، حالت تهوع، سردرد و خستگی ظاهر می شود. به طور کلی، زمانی که اوزون به درستی و با دوز توصیه شده تجویز شود، یک درمان بسیار ایمن است. عوارضی مانند آمبولی هوا شرح داده شده است، اما به دلیل شیوه های تجویز نادرست و استفاده از تجهیزات غیرمجاز ایجاد می شود.
چندین کشور از جمله اسپانیا، ایتالیا، یونان، کوبا، روسیه، پرتغال و ترکیه اوزون درمانی را برای دیگر علت های درمانی نیز استفاده میکنند.
پاتوژنز این ویروس متغیر است و به طور کامل شناخته نشده است. این بیماری عمدتاً ریهها را درگیر میکند که در آن آسیب آلوئولی منتشر با درگیری میکروسیرکولاسیون منجر به هیپوکسی مشخص میشود. اختلال در پاسخ ایمنی وجود دارد و لنفوسیتوپنی یک علامت مشخص در اکثریت قریب به اتفاق این بیماران است. ایمنی ذاتی و مسیرهای انعقادی به طور پیچیده با هم مرتبط هستند. فعال شدن ماکروفاژهای مرتبط با کووید-۱۹، هیپرفریتینمی، طوفان سیتوکین، انتشار الگوهای مولکولی مرتبط با پاتوژن و پروتئینهای مولکولی مرتبط با آسیب میتواند منجر به آزاد شدن فاکتور بافتی و فعال شدن فاکتورهای انعقادی شود که بستر را برای انعقاد بیش از حد فراهم میسازد.
بر اساس کیس ریپورت ها، استفاده از اتوهمتراپی ازن دار را در بیماران مبتلا به پنومونی شدید COVID-19 گزارش کرده اند که با این حال، محدودیت هایی داشتند. اخیراً یک مطالعه مورد-شاهدی گذشته نگر روی ۶۰ بیمار مبتلا به پنومونی خفیف تا متوسط COVID-19 منتشر شده است.
بنابراین، ما یک مطالعه مورد-شاهدی آیندهنگر را انجام دادیم که با بستری شدن در بیمارستان بر اساس در دسترس بودن تخت تعیین شد تا مشخص کنیم که آیا اتوهمتراپی ازن با طول درمان کوتاهتری برای بهبود بالینی در بیماران مبتلا به پنومونی شدید COVID-19 مرتبط است یا خیر.
۲. مواد و روش ها
۲.۱. طراحی مطالعه
این مطالعه مورد-شاهدی آینده نگر در بیمارستان Policlinica Ibiza در اسپانیا انجام شد. مطالعه مطابق با اعلامیه هلسینکی انجام شد و توسط کمیته اخلاق تحقیقات انسانی چند رشته ای (HREC) در موسسه تایید شد. هر یک از شرکتکنندگان برای انجام هرگونه مداخله، جمعآوری دادههای بالینی مرتبط و تعیین پیامدها رضایت کتبی و آگاهانه دادند. این مطالعه شامل همه بزرگسالان (بالای ۱۸ سال) بود که با تشخیص ذات الریه شدید ناشی از COVID-19 بین ۲۰ مارس تا ۱۹ آوریل ۲۰۲۰ در بیمارستان بستری شدند. همه بیماران شامل معیارهای زیر بودند: عفونت COVID-19 تأیید شده (تشخیص داده شده با سواب نازوفارنکس که هنگام پذیرش انجام شد). ذات الریه همراه با ناهنجاری های اولیه اشعه ایکس قفسه سینه؛ اشباع اکسیژن کمتر از ۹۴ درصد در هوای اتاق و تاکی پنه با تعداد تنفس بیش از ۳۰ در دقیقه.
بیماران بستری شده در بیمارستان در طول دوره مطالعه بر اساس در دسترس بودن تخت در تخت های متفاوتی قرار گرفتند. بسته به تختی که بیمار بستری شده بود، درمان اتوهمتراپی ازن یا درمان استاندارد بود.
۲.۲. مراقبت های بالینی استاندارد
درمان برای همه بیماران مبتلا به پنومونی COVID-19 شامل اکسیژن درمانی مکمل، هیدروکسی کلروکین، لوپیناویر/ریتوناویر، کورتیکواستروئیدها و آنتی بیوتیک ها (از جمله آزیترومایسین) بنا به صلاحدید پزشک معالج هر بیمار بود. دوز داروها دوز استاندارد بود: سفتریاکسون ۲ گرم q24h به مدت ۵ روز، لووفلوکساسین ۵۰۰ میلی گرم در q12h، هیدروکسی کلروکین ۴۰۰ میلی گرم در q24h برای ۴ روز، دگزامتازون ۶ mg q24h برای ۱۰ روز یا متیل پردنیزولون ۴۰ mg q2h3 و ۴۰ mg q2h1. نه رمدسیویر و نه توسیلیزوماب به هیچ بیمار داده نشد. انوکساپارین ۱ mg/kg SC q12h به عنوان دوز ضد انعقاد درمانی استفاده شد. تصمیم گیری در مورد لوله گذاری داخل تراشه، تهویه مکانیکی و پذیرش در بخش مراقبت های ویژه با رعایت استانداردهای بالینی و با صلاحدید پزشک معالج بیمار اتخاذ شد.
۲.۳. اتوهمتراپی ازن دار
خون ازن شده دو بار در روز به مدت ۵ روز متوالی داده شد. اتوهمتراپی ازن دار شامل انفوزیون داخل وریدی خون کامل اتولوگ ازن دار بود. در ابتدا، ۲۰۰ میلیلیتر خون کامل اتولوگ از ورید انتکوبیتال بیمار به یک کیسه استاندارد جمعآوری خون یکبار مصرف پلاستیکی (کیسه گواهی SANO3) حاوی ۳۵ میلیلیتر محلول سیترات دکستروز ضد انعقاد (ACD-A) کشیده شد. سپس خون با ۲۰۰ میلی لیتر مخلوط گاز اکسیژن-ازن با غلظت ازن ۴۰ میکروگرم بر میلی لیتر که توسط Ozonobaric P Sedecal، که یک مولد ازن با گواهی CE0120 نوع IIb است به دست آمد و غنی شد. سپس خون ازنیزه شده مجدداً در همان ورید در مدت تقریباً ۱۰ تا ۱۵ دقیقه تزریق شد.
۲.۴. عواقب
۲.۴.۱. نتیجه اولیه
نتیجه بالینی اولیه طول زمان بهبود بالینی در طول بستری در بیمارستان بود.
۲.۴.۲. ارزیابی بالینی
بهبود بالینی به عنوان کاهش دو امتیازی (نسبت به وضعیت بیمار در بستری شدن در بیمارستان) در مقیاس ترتیبی شش درجه ای یا ترخیص از بیمارستان، هر کدام که زودتر اتفاق بیفتد، تعریف شد. مقیاس شش درجه ای به شرح زیر بود: مرگ (۶ امتیاز). اکسیژن رسانی غشای خارج بدنی یا تهویه مکانیکی که نیاز به لوله گذاری دارد (۵ امتیاز). تهویه غیرتهاجمی یا اکسیژن درمانی High Flow (4 امتیاز). اکسیژن درمانی بدون نیاز به اکسیژن High Flow یا تهویه غیرتهاجمی (۳ امتیاز)؛ بستری در بیمارستان بدون نیاز به اکسیژن درمانی (۲ امتیاز)؛ و از بیمارستان مرخص شده یا به معیار ترخیص رسیده است (۱ امتیاز). معیارهای jvodw به عنوان شواهدی از بهبودی بالینی (عادی سازی تب، تعداد تنفس <24 در دقیقه، اشباع اکسیژن > 94٪ در هوای اتاق و عدم وجود سرفه) برای حداقل ۷۲ ساعت بود.
این مقیاس شش نقطهای و تعریف بهبود بالینی (یعنی بهبود دو نقطهای در مقیاس) در تحقیقات قبلی در مورد مداخله در ارتباط با عفونت COVID-19 استفاده شده است. کارکنانی که نتایج را به دست میآورند، از اینکه آیا بیماران مراقبتهای معمول را در مقابل اتوهمتراپی اوزون دار دریافت میکنند، Blind نشدهاند.
۲.۴.۳. نتایج ثانویه
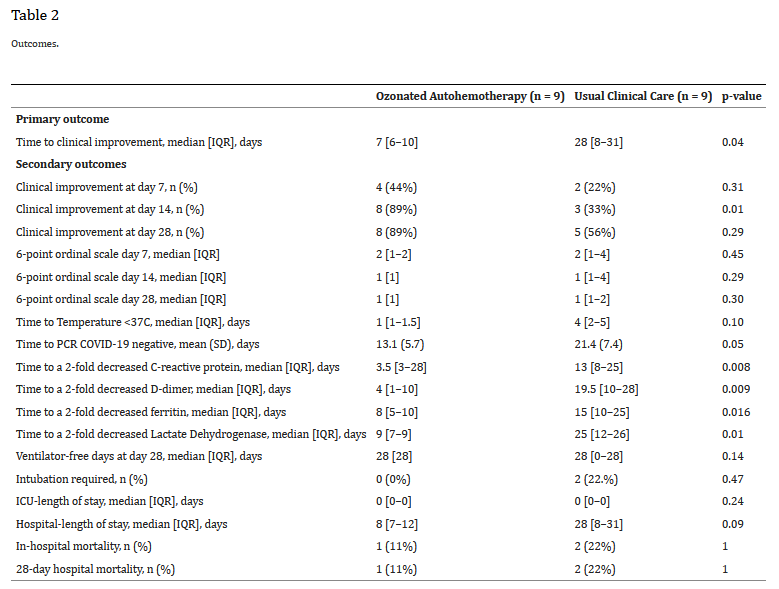
پیامدهای ثانویه بهبود بالینی در روزهای ۷، ۱۴ و ۲۸ پس از پذیرش در بیمارستان اندازه گیری شد. زمان کاهش دو برابری در غلظت پروتئین واکنشگر C، فریتین، D-دایمر و لاکتات دهیدروژناز نیز روزانه اندازهگیری شد. سایر پیامدهای ثانویه عبارتند از: تعداد روزهای بدون ونتیلاتور در روز ۲۸، نرخ لوله گذاری، طول مدت بستری در بیمارستان، مرگ و میر طی ۲۸ روز و زمان (روزها) منفی شدن PCR COVID-19. پیگیری در شرایط زیر متوقف شد:ترخیص از بیمارستان، مرگ بیمار، گذشت ۳۱ روز از پذیرش در بیمارستان.
۲.۴.۴. تحلیل آماری
همه تجزیه و تحلیل ها با استفاده از STATA نسخه ۱۳.۰ (StataCorp. 2013. Stata Statistical Software: Release 13. College Station، TX: StataCorp LP) انجام شد. اهمیت آماری با مقدار P دو طرفه کمتر از ۰.۰۵ تعریف شد. از آزمون Shapiro-Wilk برای تعیین اینکه آیا متغیرها به طور نرمال توزیع شده اند یا خیر استفاده شد. سپس تفاوتهای تعدیلنشده بین گروههای درمان و کنترل با استفاده از آزمون t دو نمونهای (متغیرهای پیوسته با توزیع نرمال)، آزمون U Mann-Whitney (متغیرهای پیوسته با شواهدی از توزیعهای غیرعادی) و آزمون دقیق فیشر (متغیرهای طبقهبندی) محاسبه شد. زمانهای تعدیلنشده برای بهبود بالینی بین دو بازوی مطالعه با استفاده از منحنیهای Kaplan-Meier و آزمون log-rank مقایسه شد. بیماران در هنگام ترخیص از بیمارستان، مرگ یا ۳۱ روز پس از پذیرش در بیمارستان، هر کدام که زودتر اتفاق بیفتد، حذف شدند. ارتباط تعدیل شده بین اتوهموتراپی ازن دار و میانگین زمان بهبود بالینی با استفاده از یک مدل رگرسیون خطی چند متغیره که برای سن، جنس، و نمره ارزیابی سریع نارسایی متوالی ارگان (SOFA) تنظیم شده بود، برآورد شد. این متغیرهای کمکی بر اساس اهمیت بالینی آنها از قبل مشخص شدند. به بیمارانی که در دوره پیگیری به بهبود بالینی دست نیافته بودند، مقدار زمانی ۳۱ روز در نظر گرفته شد. همه بیمارانی که در یک دوره یک ماهه عملگرایانه در محل مطالعه بستری شدند در گروه مطالعه قرار گرفتند.
۳. نتایج
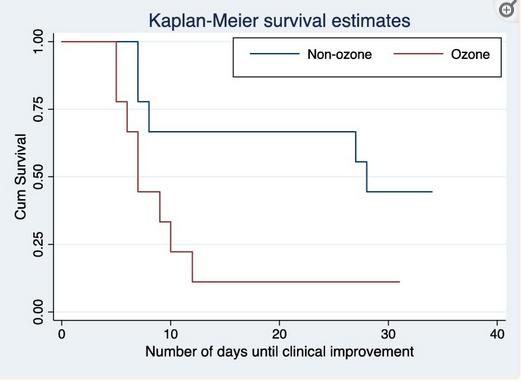
گروه شامل ۱۸ بیمار بود. میانگین سنی ۶۸ سال (انحراف معیار ۱۵ سال) و ۲/۷۲ درصد (۱۳ نفر) مرد بودند. ویژگی های پایه این بیماران در جدول ۱ ارائه شده است. در مجموع، ۹ بیمار (۵۰%) اتوهمتراپی ازن دریافت کردند. ویژگیهای پایه دو بازوی مطالعه از نظر کیفی مشابه بود، به غیر از سن (میانگین سن در بازوی مراقبت معمول بالاتر بود)، وزن (میانگین وزن در بازوی مراقبت معمول بیشتر بود)، و شاخص توده بدن (مقدار متوسط در بازوی مراقبت معمول بالاتر بود).
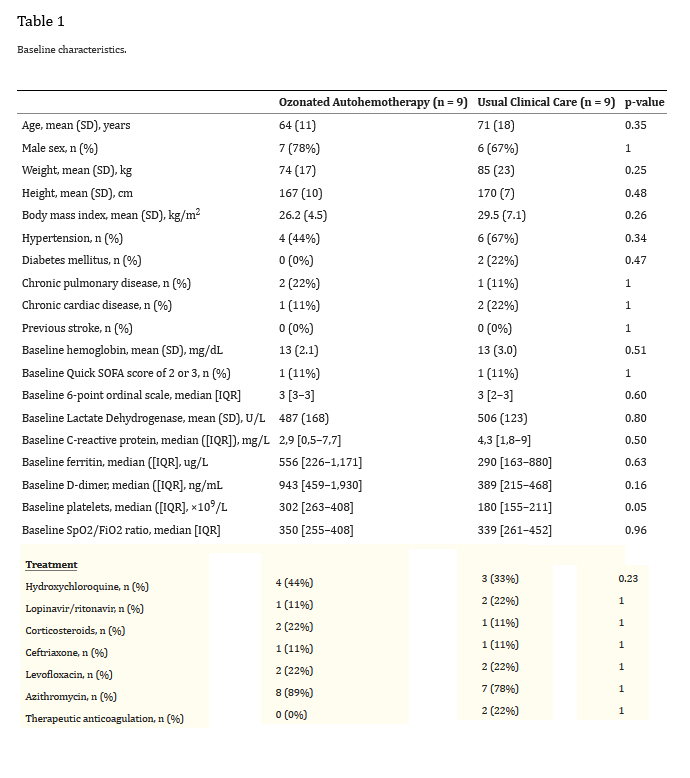
۳.۱. نتیجه اولیه: زمان بهبود بالینی
اتوهمتراپی ازن دار با زمان قابل توجهی کمتر برای بهبود بالینی (متوسط [IQR])، ۷ روز [۶-۱۰] در مقابل ۲۸ روز [۸-۳۱]، ۰.۰۴ = p) همراه بود (شکل ۱ و جدول ۲). در آنالیزهای رگرسیون خطی تنظیم نشده، میانگین زمان بهبود بالینی ۱۲.۴ روز در بازوی اتوهمتراپی ازن شده کوتاهتر بود (۱۲.۴- روز؛ ۰.۰۱ = p؛ ۹۵% فاصله اطمینان (CI): 22.49- تا ۲.۳۹-). در آنالیزهای رگرسیون خطی تنظیمشده، میانگین زمان بهبود بالینی در بازوی اتوهمتراپی ازندار ۱۱.۳ روز کوتاهتر بود (۱۱.۳- روز، ۰.۰۴ = p، ۹۵% فاصله اطمینان (CI): 22.25- تا ۰.۴۲-). ما یک تجزیه و تحلیل حساسیت Post-Hoc انجام دادیم که برای سن، SOFA سریع و وزن تنظیم میشد و همه این ویژگیهای مذکور با تفاوتهای کیفی بین بازوهای مطالعه بودند. تفاوت تعدیل شده در زمان تا بهبود بالینی (۶/۱۱- روز، ۰۵/۰ = p، ۹۵% فاصله اطمینان (CI): 3/23- تا ۴۱/۰) از نظر کیفی در این تحلیل حساسیت مشابه بود. زمانهای تعدیلنشده برای بهبود بالینی با استفاده از منحنیهای بقای Kaplan-Meier و آزمون log-rank تفاوت معنیداری را بین گروهها نشان داد (Log Rank (Mantel-Cox) Chi-square 4,182. p = 0,041) (شکل ۱).
۴. بحث
در این مطالعه مورد-شاهدی آیندهنگر روی ۱۸ بیمار مبتلا به پنومونی شدید COVID-19 تأیید شده، اتوهمتراپی دو بار در روز با ازن به مدت ۵ روز متوالی با کاهش قابل توجهی در زمان بهبود بالینی همراه بود. این مطالعه مورد-شاهدی دادههای جدیدی را ارائه میکند که به نقش بالقوه اتوهمتراپی ازن دار برای درمان پنومونی شدید COVID-19 اشاره میکند.
یافتههای ما با بررسیهای اخیر که مزایای بالقوه قابل قبول بیولوژیکی مرتبط با اتوهمتراپی با ازن برای COVID-19 را توصیف میکند و همچنین با مطالعه مورد شاهدی گذشتهنگر اخیراً منتشر شده مطابقت دارد.
تاسینی و همکاران در مطالعه مورد-شاهدی خود، بر روی ۶۰ بیمار مبتلا به ذات الریه COVID-19 خفیف تا متوسط، که هر دو گروه تحت درمان با بهترین درمان در دسترس بودند، ارتباط بین استفاده از ازن در خون و کاهش قابل توجه فنوتیپ بالینی SIMEU را بر اساس انجمن اورژانس و فوریت پزشکی ایتالیا نشان دادند (۰.۸۷±۰.۸۷ ± ۰.۸۷ p. 01) . در حالی که در گروه کنترل تفاوت آماری معنی داری وجود نداشت. علاوه بر این، بهبود بالینی مرتبط با استفاده از O3 ، در مقایسه با گروه کنترل بیشتر بود (۵۳٪ در مقابل ۳۳٪). در گروه بیماران، تنها ۷ درصد از بیماران عواقب بدتری داشتند، در حالی که در گروه کنترل این نرخ ۱۷ درصد بود. مانند گروه ما، هیچ عارضه جانبی مرتبط با درمان با خون ازن دار در این مطالعه مشاهده نشد. از بین ۳۰ بیمار تحت درمان با خون ازن دار ۲۸ نفر سه جلسه متوالی و ۲ نفر دو دوز متوالی به مدت ۳ روز دریافت کردند. دوز مورد استفاده ۲۰۰ میلی لیتر مخلوط گاز اکسیژن-ازن با غلظت ازن ۴۰ میکروگرم بر میلی لیتر بود. در مطالعه ما، همان دوز دریافت شد. با این حال، به جای ۳ جلسه در روز، دو بار در طول ۵ روز اوزون تجویز شد. در مطالعه Tascini et al. کاهشی در فنوتیپ بالینی SIMEU از ابتدای شروع درمان تا ترخیص وجود داشت و بهبود بالینی مرتبط با استفاده از O3 در مقایسه با گروه کنترل بیشتر بود (۵۳٪ در مقابل ۳۳٪). با این حال، تفاوتی در بستری شدن در بیمارستان وجود نداشت (۳.۸۴ ± ۹.۳۷ در مقابل ۵.۳۸ ± ۹.۳۷؛ p = 1).
نقش بالقوه ای برای اتوهمتراپی ازن دار برای درمان بیماران مبتلا به پنومونی شدید COVID-19، با چندین مکانیسم عمل قابل قبول بیولوژیکی وجود دارد. هنگامی که خون انسان در معرض مخلوط گازی از اکسیژن و ازن قرار می گیرد، اکسیژن با آب خارج سلولی و داخل گلبول های قرمز قبل از اتصال به هموگلوبین متعادل می شود تا زمانی که به طور کامل اکسیژنه شود. برعکس، ازن که از اکسیژن محلول تر است، به آسانی در آب حل می شود و فوراً با مولکول های زیستی مانند اسیدهای آمینه (به ویژه سیستئین، تریپتوفان، متیونین، فنیل آلانین و تیروزین) و با لیپیدها (به ویژه اسیدهای چرب غیراشباع موجود در غشاهای غیراشباع چربی) واکنش نشان می دهد. اولی می تواند دی سولفید و متیونین سولفوکسید تولید کند. دومی می تواند پراکسید هیدروژن، آلدهیدها و هیدروکسی هیدروپراکسیدها را تولید کند. ترکیبات تولید شده در طی واکنشها [گونههای اکسیژن فعال (ROS) و محصولات ازنزنی لیپیدی (LOPs)] نشاندهنده «پیامرسانهای ازن» هستند و مسئول اثرات بیولوژیکی و درمانی آن هستند، بنابراین ازن را میتوان به عنوان یک داروی جانبی که پیامرسانهای بیوشیمیایی تولید میکند نیز در نظر گرفت.
پتانسیل خاص ازن در برابر ویروس کرونا و اثربخشی ازن در برابر عوامل بیماری زا به خوبی شناخته شده است. به نظر می رسد که ازن بهترین عامل موجود برای استریل کردن آب باشد، اگرچه فعالیت ویروس کشی ازن در دوز مورد استفاده در این مطالعه ناشناخته است. پیشنهاد شده است که ازن می تواند به عنوان یک مولکول سیگنال در ارگانیسم عمل کند، که توسط نوتروفیل های انسانی تولید می شود و برای تشکیل کاتالیزور آنتی بادی که در پاسخ هومورال طبیعی به عفونت نقش دارد، ضروری است. ازن همچنین قادر به القای آزادسازی و تعدیل IFN-γ، TNF-α است و همچنین قادر به تعدیل و تحریک عملکرد فاگوسیتی است که ممکن است تأثیر بسیار مثبتی در عفونت COVID-19 داشته باشد.
در نهایت، همانطور که در اثرات آن بر SARS و MERS پیشنهاد شده است، ازن ممکن است تکثیر ویروس را مختل کند. گیرنده های سلولی آنزیم تبدیل کننده آنژیوتانسین نوع ۲ (ACE2) به عنوان گیرنده SARS-CoV-2 شناسایی شده است که می تواند با آنتی بادی های مونوکلونال خاص مسدود شود اما همچنین از طریق کنترل فاکتور هسته ای اریتروئید ۲ فاکتور ۲ (Nrf2) که فعالیت این گیرنده را تنظیم و مسدود می کند. از آنجایی که ازن میتواند باعث فعالسازی سریع Nrf2 شود، به نظر میرسد که این ممکن است یک مکانیسم فیزیولوژیکی مهم برای جلوگیری از تکثیر درونزا COVID-19 با جلوگیری از تماس با این گیرنده باشد. علاوه بر این، پروتئین های اسپایک (S) مسئول اتصال گیرنده و همجوشی غشاء هستند. این شامل یک گذرگاه بسیار حفاظت شده است که از سه بخش تشکیل شده است: یک دامنه N ترمینال غنی از تریپتوفان، یک دامنه مرکزی و یک دامنه C-ترمینال غنی از سیستئین. هر دو، دامنه غنی از سیستئین و دامنه غنی از تریپتوفان، برای همجوشی ضروری هستند. سیستئین و تریپتوفان هر دو به اکسیداسیون حساس هستند. این فرضیه وجود دارد که متابولیت های ازن می توانند باقی مانده های سیستئین را اکسید کنند و ورود ویروس به سلول میزبان را دشوار کرده و از تکثیر ویروس جلوگیری می کند.
این مطالعه نیاز به تحقیقات بیشتر، مانند یک کارآزمایی بالینی تصادفی چند مرکزی خوب طراحی شده، اشاره دارد. محدودیتها شامل اندازه نمونه گروه ما کوچک و تک مرکزی است. ۹۵٪ CI برای برآوردهای تعدیل شده ما گسترده بود، و کاهش ۲۰-۳۰٪ در ضریب زمان (روزها) تا بهبود بالینی را رد نمی کند. گروهی که اتوهمتراپی با ازن دریافت کردند کمی جوانتر بودند و شاخص توده بدنی پایین تری داشتند. با این حال، یک تجزیه و تحلیل حساسیت تعدیل شده برای سن، SOFA و وزن انجام شد و تجزیه و تحلیل تنظیم شده نتایج را تایید کرد. علاوه بر این، از آنجایی که این یک مطالعه مشاهدهای بود، IL-6 و سایر سیتوکینها را نمیتوان اندازهگیری کرد. نقاط قوت این مطالعه شامل جمعیت واقعی کووید-۱۹ در دنیای واقعی، استفاده از پیامد بالینی اولیه عینی و تنظیم ریسک با استفاده از روشهای تحلیل مدلسازی رگرسیون است.
در نتیجه، استفاده از اتوهموتراپی ازن دار با زمان بسیار کوتاه تری برای بهبود بالینی و زمان کوتاهتر برای کاهش دو برابری CRP، فریتین، D-دایمر و لاکتات دهیدروژناز در بیماران مبتلا به پنومونی شدید COVID-19 در این مطالعه مورد-شاهدی آیندهنگر همراه بود.

