فعالیت محافظتی سلولی بالقوه – اوزون درمانی با روش سالین DIVهاوارد رابینس در
SARS-Co V-2/COVID-19
چکیده
(۱) زمینه: ظهور بیماری سندرم حاد تنفسی ویروس کرونا ۲ (SARS-CoV-2) (COVID-19) در چین در پایان سال ۲۰۱۹ زمینه ساز شیوع گسترده جهانی شده است. (اوزون درمانی با روش سالین DIV هاوارد رابینس سیستمیک (OT) می تواند به طور بالقوه در مدیریت بالینی چندین عارضه ثانویه در حوزه SARS-Co V-2 مفید باشد. منطق و مکانیسم عمل قبلاً از نظر بالینی در سایر عفونت های ویروسی به اثبات رسیده است و در مطالعات تحقیقاتی نشان داده شده است که در کاهش آسیب اندام ناشی از التهاب و استرس اکسیداتیو بسیار مؤثر است. این بررسی، مطالعات OT را خلاصه میکند که مکانیسم احتمالی محافظت سلولی اوزون و محصولات جانبی فیزیولوژیکی آن را در مورد اندامهای هدف تحت تأثیر SARS-CoV-2 نشان میدهد.
(۲) روشها: این ارائه در مجموع ۷۴ مقاله اصلی بررسی شده را در بر میگیرد. این بررسی عمدتا بر روی اوزون به عنوان تعدیل کننده مسیرهای NF-KB/Nrf2 و بیان IL-6/IL-lf3 متمرکز است.
(۳) نتایج: در مدلهای تجربی و معدود مطالعات بالینی موجود، هموستاز تعادل رادیکالهای آزاد و آنتیاکسیدانی توسط OT با تعدیل تعادل NF-KB/Nrf2 و بیان IL-6 و IL-lf3 همراه بود. این مکانیسمهای مولکولی از اثرات سیتوپروتکتیو OT در برابر آسیب بافتی موجود در بسیاری از بیماریهای التهابی، از جمله عفونتهای ویروسی، پشتیبانی میکنند.
(۴) نتیجهگیری: نقش بالقوه محافظت سلولی OT در مدیریت آسیب اندام ناشی از COVID-19 نیازمند تحقیقات بیشتر می باشد و آزمایشات بالینی کنترل شده مورد نیاز است.
واژگان کلیدی: اوزون درمانی با روش سالین DIV هاوارد رابینس۱؛ SARS-CoV-2؛ مسیر Keapl/Nrf2/ARE؛ NF-KB; Nrf2
کرونا ویروس ها پاتوژن های مهم انسانی و حیوانی هستند. در پایان سال ۲۰۱۹، یک کروناویروس جدید به عنوان عامل خوشه ای از موارد ذات الریه در ووهان (استان هوبی چین) شناسایی شد و موجب شیوع گسترده جهانی شد که نشان دهنده یک مشکل عمده بهداشت عمومی است [۱]. این بیماری به سرعت گسترش یافت و منجر به یک اپیدمی در سراسر چین شد و موارد افزایش یافته در سطح جهانی گزارش شد. در فوریه ۲۰۲۰، سازمان بهداشت جهانی بیماری کووید-۱۹ را که مخفف بیماری کروناویروس ۲۰۱۹ است، اعلام نمود [۲]. ویروسی که باعث COVID-19 می شود به عنوان سندرم حاد تنفسی ویروس کرونا ۲ (SARS-CoV-2) شناخته می شود که قبلاً از آن به عنوان -nCoV2019 یاد می شد. SARS-CoV-2 ارتباط نزدیکی با دو کروناویروس شبیه به سندرم تنفسی حاد حاد ناشی از خفاش دارد، bat-SL-CoVZC45 و bat-SL-CoVZXC21، به ویژه BetaCoV/bat/Yunnan/RaTG13/2013 شبیه سارس انسانی هستند. -CoV-2 [3]. این مورد نشان داده شده است که دارای تنوع ژنتیکی زیاد و تکامل سریع است [۴].
SARS-Co V-2 از طریق انتقال انسان به انسان به واسطه قطرات تنفسی یا تماس مستقیم منتشر می شود و میانگین دوره نهفتگی عفونت ۶.۴ روز و مدت اولیه تکثیر (۲.۲۴-۳.۵۸) روز برآورد شده است [۱]. در میان بیماران مبتلا به پنومونی ناشی از SARS-CoV-2، تب شایعترین علامت بود و به دنبال آن سرفه، ضعف و سرفه خشک در مرحله پرودرومال قرار داشت [۵].
درگیری دو طرفه ریه با کدورت شیشه ای رایج ترین یافته از تصاویر توموگرافی کامپیوتری (CT) از قفسه سینه بود. پیشرفت این پدیده رادیوگرافی در تصاویر CT از مراحل اولیه شروع بیماری مشاهده شد [۶].
در حال حاضر هیچ داروی ضد ویروسی دارای مجوز از سازمان غذا و داروی ایالات متحده (FDA)، آژانس دارویی اروپا (EMA)، آژانس اسپانیایی داروها و تجهیزات پزشکی (AEMPS) یا آژانس دارویی ایتالیا برای درمان بیماران مبتلا به کووید-۱۹ وجود ندارد. . طبق اطلاعات نویسندگان، هیچ داروی ضد ویروسی برای درمان بیماران مبتلا به COVID-19 تاکنون در هیچ کشوری در جهان مجوز نداشته است. این نکته به طور رسمی توسط WHO تأیید شده است: “در حال حاضر، هیچ واکسن یا درمان دارویی خاصی برای COVID-19 در دسترس نیست” [۷]. برخی از مطالعات in vitro یا in vivo فعالیت درمانی بالقوه ترکیبات در برابر کروناویروسهای مرتبط را پیشنهاد میکنند، اما در حال حاضر هیچ دادهای از مطالعات مشاهدهای یا کارآزماییهای تصادفیسازی شده کنترلشده بر روی انسان برای حمایت از توصیههای درمانی تحقیقاتی برای بیماران مبتلا به COVID-19 تأیید شده یا مشکوک وجود ندارد.
Title
Subtitle
Remdesivir، یک داروی ضد ویروسی تحقیقاتی، گزارش شده است که علیه SARS-Co V-2 فعالیت in vitro دارد [۸]. تعداد کمی از بیماران مبتلا به COVID-19 برای استفاده دلسوزانه خارج از محیط کارآزمایی بالینی رمدسیویر داخل وریدی دریافت کرده اند. یک کارآزمایی بالینی تصادفی کنترل شده با دارونما Remdesivir برای درمان بیماران بستری در بیمارستان مبتلا به پنومونی و COVID-19 در چین اجرا شده است. کارآزمایی با برچسب باز تصادفی اولیه و امیدوارکننده ترکیبی از Lopinavir-Ritonavir در نهایت مفید واقع نشد [۹]. سایر داروها و پروتکلهای درمانی که در کارآزماییهای بالینی چینی مورد استفاده قرار گرفتهاند عبارتند از Duranavir، Danoprevir، Cobisistat، Anti-CD147 Humanized Meplazumab، Eculizumab، Bevacizumab، آنزیم تبدیلکننده آنژیوتانسین انسانی نوترکیب ۲ (rhACE2)، سلولهای NKd (UCd-Umbilical) سلول های بنیادی مزانشیمی مشتق شده (MSCs)، ایمونوگلوبولین ها، تنظیم کننده های گیرنده اسفنگوزین-۱-فسفات فینگولیمود، هیدروکسی کلروکین، ویتامین C داخل وریدی، ویتامین D، IFN بتا، گلوکوکورتیکوئیدها، اتوهمتراپی اوزون دار (این یکی از موارد بسیار و ترکیبات مورد آزمایش می باشد که هنوز داده های موفقیت آمیزی در مورد آنها وجود ندارد). کد آزمایشی: ChiCTR2000030165، ChiCTR2000030102 و ChiCTR2000030006) و داروهای طب سنتی چینی، اما تا به امروز هیچ نتیجهای در دسترس نیست. آزمایشهای بالینی سایر درمانهای بالقوه برای COVID-19 در حال برنامهریزی است [۱۰،۱۱]. هیچ داروی درمانی خاصی پیدا نشده است [۱۲].
در حالی که به نظر می رسد راه اصلی انتقال از طریق یک راه تنفسی باشد، SARS-CoV در دستگاه روده، کلیه و غدد عرق بیماران مبتلا مشاهده شده است و بنابراین ممکن است از طریق مدفوع، ادرار و عرق دفع و منتقل شود. [۱۳]. آنزیم مبدل آنژیوتانسین ۲ (ACE2) به احتمال زیاد به عنوان محل اتصال SARS-CoV-2 عمل می کند، سویه ای که در همه گیری کووید-۱۹ فعلی نقش دارد و مشابه سویه SARS-CoV دخیل در اپیدمی SARS 2002-2003 می باشد ]۱۴]. در این اپیدمی، عمده ترین بیماری های همراه در موارد کشنده شامل فشار خون بالا، دیابت، بیماری عروق کرونر قلب، انفارکتوس مغزی و برونشیت مزمن بود. منبع ویروس سارس ۲۰۰۲-۲۰۰۳ و پاتوژنز آن هنوز تایید نشده است.
بیشتر بخوانید: اوزون چیست؟
اوزون (۰۳) شکل آلوتروپ سه اتمی اکسیژن است که قدرت اکسیدانی آن بعد از فلوئور و پرسولفات سومین و بالاتر از ۰۲ است [۱۵]. برای (اوزون درمانی با روش سالین DIV هاوارد رابینس (OT)، در محیط پزشکی، از مخلوط گاز ۰۲/۰۳ استفاده می کند که از اصلاح اکسیژن با درجه پزشکی با استفاده از یک دستگاه اوزون مولد به دست آمده است که به دلیل نیمه عمر کوتاه اوزون باید در محل مصرف شود. در دمای ۲۰ درجه سانتیگراد، غلظت ۰۳ در عرض ۴۰ دقیقه به نصف و در ۳۰ درجه سانتیگراد در ۲۵ دقیقه کاهش می یابد [۱۵]. غلظت های معمول بالینی ۰۳ از ۱۰ تا ۶۰ میکروگرم بر میلی لیتر (با استفاده از ۰۲ به عنوان حامل) متغیر است که بر اساس درصد، ممکن است به صورت مخلوطی از ۰۳ (۰.۵-۰.۰۵٪) و ۰۲ (۹۵-۹۹.۵٪) باشد [۱۶]. مکانیسم اصلی 02f03 در فیزیولوژی انسان با مفهوم پیش شرطی سازی اکسیداتیو مطابقت دارد [۱۷]. این مفهوم اکنون در هر دو سطح پروتئومی و ژنومی [۱۸]، در مطالعات آزمایشگاهی و در آزمایشات بالینی نشان داده شده است [۱۹]. یک محرک اکسیدان کالیبره شده تا ۰۲/۰۳ می تواند سیستم آنتی اکسیدانی درون زا را تعدیل نموده و به کنترل شرایط مختلف پاتولوژیک کمک کند [۲۰]. مدولاسیون 02f03 در مسیر Keapl/Nrf2/ARE و کاهش IL-6 و IL-lf3 در مکانیسم اثر اوزون نقش دارند [۲۱]. این مهم نشان می دهد که اثر محافظت سلولی مشاهده شده در طول درمان ۰۲/۰۳ ممکن است بر شرایط بالینی ناشی از SARS-CoV-2 تأثیر بگذارد.
این بررسی بر روی اثر محافظت سلولی ۰۲/۰۳ در بافتهای مختلف متمرکز و عمدتاً از طریق مدولاسیون مسیرهای NF-KB/Nrf2 و سیتوکینهای IL-6 و IL-lf3 انجام شده است. شواهد پیش بالینی و بالینی برای حمایت از نقش بالقوه OT در پیشگیری و مدیریت سمیت سلولی ناشی از داروها و بیماریهای مختلف از جمله بیماریهای ویروسی وجود دارد [۲۱-۲۴].
مکانیسم اصلی مربوط به تعدیل استرس اکسیداتیو و سیتوکین های پیش التهابی است. شرایط کسب شواهد موجود در جستجوی اطلاعات عبارتند از: COVID-19، SARS-CoV-2، SARS، اوزون، OT، پنومونی ویروسی. پایگاههای اطلاعاتی کتابشناختی مورد استفاده: MEDLINE/PubMed، SciELO، LILACS، PAHO، EMBASE، ZOTERO ISC03، پلتفرم ثبت کارآزماییهای بالینی بینالمللی WHO و NIH. در کتابخانه ملی پزشکی ایالات متحده نوع اسناد بررسی شده بین سالهای ۱۹۸۰ تا ۲۰۲۰ به زبان روسی یا انگلیسی منتشر شد و شامل: مقالات اصلی، پایاننامه منتشر شده، گزارشهای بالینی، کارآزماییهای بالینی در حال انجام و بررسیهای کتابشناختی بود. معیارهای خروج، عدم دسترسی آزاد به متن کامل به دلیل محدودیت های مالی و/یا مطالعاتی که با شواهد علمی ناکافی داشتند، بود.
Title
Subtitle
اقدامات درمانی بالقوه اوزون در بیماری های ویروسی
اوزون می تواند ویروس ها را از طریق اکسیداسیون مستقیم اجزای آن غیرفعال کند [۲۵]. با این حال، فعالیت ویروس کشی در داخل بدن زمانی که ویروس ها در مایعات بیولوژیکی هستند یا حتی بدتر از آن، زمانی که داخل سلولی هستند (پنوموسیت ها، هپاتوسیت ها، اپیتلیوم، لنفوسیت های CD4+، مونوسیت ها، سلول های گلیال و سلول های عصبی) نامشخص می شود، زیرا سیستم آنتی اکسیدانی قوی سلول از یکپارچگی ویروس محافظت می کند [۱۵]. به همین دلیل است که استفاده از تزریق l.V مستقیم گاز یا سایر روش های غیر توصیه شده برای استفاده از اوزون غیر منطقی است [۱۶،۲۶]. OT نشان دهنده یک درمان کمکی و مکمل مفید است اما نه اوزون و نه H202 (یکی از واسطه های اصلی ۰۳) نمی توانند در بافت ها به غلظت کافی برسند زیرا ظرفیت آنتی اکسیدانی پلاسما از پاتوژن های آزاد محافظت می کند و ویروس های داخل سلولی غیرقابل دسترس هستند [۲۷]. به منظور بررسی اثربخشی OT در بیماری های ویروسی، Bocci و Paulesu [28] این امکان را توضیح دادند که چگونه اوزون ممکن است در داخل بدن عمل کند. مکانیسم های زیر ممکن است مرتبط باشند:
۱. به نظر میرسد که درمان طولانیمدت (اوزون درمانی با روش سالین DIV هاوارد رابینس قادر به ایجاد سازگاری با استرس اکسیداتیو است، بنابراین تعادل مجدد حالت ردوکس سلولی، که یک فرآیند اساسی برای مهار تکثیر ویروسی است. مکانیسم متناقضی که توسط اوزون (یک اکسیدان قوی) می تواند پاسخ آنتی اکسیدانی را القا کند، در حال حاضر این مورد نه تنها در سطح پروتئومی، بلکه در سطح ژنومی نیز نشان داده شده است. استفاده از اوزون در دوز درمانی فاکتور هسته ای Nrf2 و NF-KB را تعدیل می کند و هموستاز محیط آنتی اکسیدانی را القا می کند [۱۸،۲۹-۳۲]. استرس اکسیداتیو و ایمنی ذاتی نقش کلیدی در مسیرهای آسیب ریوی دارند که شدت سمیت سلولی حاد ریه را در طول عفونت های ویروسی مانند SARS کنترل می کنند [۳۳].
۲. القای سیتوکین های ضد ویروسی مانند IFN و مدولاسیون سیتوکین های پیش التهابی به عنوان IL-6، با اوزون زنی خون مانند اتوهمتراپی بزرگ (MAH) نشان داده شده است. اگرچه اوزون یک القاکننده ضعیف است، لنفوسیتها و مونوسیتهای تزریق شده در طی اتوهمتراپی مایور (MAH) میتوانند از طریق سیستم لنفوئیدی مهاجرت کرده و سلولهای دیگر را فعال کنند که به مرور زمان منجر به تحریک سیستم ایمنی میشود [۳۲،۳۴]. این ممکن است یک فرآیند مهم باشد زیرا مشخص است که وضعیت یک بیماری حاد ویروسی شدیدتر می شود زیرا ویروس به ویژه بدخیم است، جمعیت ویروسی ناهمگن به سرعت تکامل می یابد و از کنترل ایمنی فرار می کند و یا دلیل آن این است که سیستم ایمنی نسبت به آنتی ژن های ویروسی مقاومت دارد و قادر به مقابله با عفونت نیست. علاوه بر این، علاوه بر القای H0-1 [18] که یک آنزیم محافظ است، برخی از پروتئینهای شوک حرارتی (HSP) مانند HSP60، HSP70 و HSP90 نیز آزاد میشوند که بر فعالیت ویروسکشی نیز تأثیر دارند. این پروتئین ها فعال کننده های قوی سیستم ایمنی ذاتی هستند و قادر به القای سیستم مونوسیت-ماکروفاژ و فعال سازی سلول های ارائه دهنده آنتی ژن هستند [۱۵،۳۵]. شواهد نشان می دهد که در طول همه گیری COVID-19، وخامت شدید برخی از بیماران ارتباط نزدیکی با یک فرآیند التهابی نامنظم به نام “طوفان سیتوکین” دارد [۳۶،۳۷].
بیشتر بخوانید: روش های متداول اوزون
۳. اکسیژن-ازون درمانی اکسیژن رسانی را [۳۸،۳۹]، به ویژه در بافت های کم اکسیژن بهبود می بخشد [۴۰].
بیماران مبتلا به SARS مستعد ابتلا به هپاتیت غیراختصاصی خفیف [۴۱]، فیبروز ریه [۴۲] و نارسایی کلیه [۴۳] هستند. OT متابولیسم کبدی را تثبیت می کند و تمایل به عادی سازی سطوح فیبرینوژن و پروترومبین پلاسما در بیماران مبتلا را دارد که نشان دهنده بهبود سنتز پروتئین کبدی است [۱۵]. تحقیقات گسترده ای وجود دارد که اثر محافظتی سلولی اوزون را برای جلوگیری از اکسیداتیو آسیب به قلب [۴۴،۴۵]، کبد [۴۶،۴۷]، ریه ها [۴۸] و بافت های کلیه [۴۹] نشان می دهد. نویسندگان در یک بررسی اخیر، اثر محافظت سلولی اوزون را برای پیشگیری و حتی درمان آسیب های ناشی از شیمی درمانی در بافت قلب، کبد، کلیه و ریه توضیح داده اند [۲۲].
۴. در طول اوزون زنی خون خارج از بدن برای اتوهمتراپی جزئی، با استفاده از غلظت اوزون نزدیک به ۹۰ میکروگرم در میلی لیتر در هر میلی لیتر خون، ممکن است القای اکسیداسیون اجزای ویروسی رایگان، که از نظر تئوری می تواند یک واکسن غیرفعال و ایمونوژن را نشان دهد، امکان پذیر باشد [۱۵. ۵۰،۵۱].
۵. محلول نمکی اوزونیزه (03SS). این روش در اوایل دهه ۱۹۸۰ توسط وزارت بهداشت فدراسیون روسیه رسمیت یافت و به طور رسمی در بیمارستان های بهداشت عمومی، به طور خاص برای تخصص های ارتوپدی، پوست، زنان و زایمان و مامایی استفاده شد [۱۶،۵۲]. در سال ۲۰۰۴، در اوکراین نیز به طور رسمی به رسمیت شناخته شد. اثرات مفید این درمان با تعداد زیادی از مقالات علمی و تجربه بالینی قوی پشتیبانی می شود. [۵۳]. این روش شامل حباب زدن و اشباع کردن یک محلول فیزیولوژیکی (۰.۹٪) با مخلوط اوزون-اکسیژن در غلظت هایی است که بسته به وزن بیمار (محدوده ۱-۵ میکروگرم کیلوگرم وزن بدن) محاسبه می شود. مصرف آن حدود ۲۰-۳۰ دقیقه طول می کشد. برخلاف MAH، 03SS به عنوان درمان مکمل در بیماریهای ویروسی مانند اپشتین بار، سیتومگالوویروس، ویروس پاپیلوم، HIV، هرپس زوستر، هرپس سیمپلکس و غیره استفاده میشود. از آنجایی که محلول نمکی یک منبسط کننده پلاسما است، 03SS نشان دهنده مقدار بیشتری از خون است. نسبت به MAH درمان می شود و بنابراین، از نظر تئوری، می توان تعداد جلسات را کاهش داد.
کورولف، بی.ا.، بویرینوف، جی.ا. و سوکولوف، V.V. [54،۵۵] نشان داد که وقتی از 03SS در طی بای پس قلبی ریوی استفاده می شود، سلول های اندام های بیمار در مقایسه با سطوح پایه از گلوکز بیشتری استفاده می کنند. بنابراین نتیجهگیری میشود که اثرات درمانی محلولهای فیزیولوژیکی اوزوندار، توسط مخلوط محلول ۰۲/۰۳، رادیکالهای آزاد، پراکسید هیدروژن و ساختارهای آبی شش ضلعی تشکیل شده در حین حباب دار کردن محلولهای آبی NaCl با مخلوطی از گاز O3/O2 تعیین میشود.

Title
Subtitle
اوزون تراپی به عنوان تعدیل کننده ردوکس
در طی استفاده سیستمیک ۰۲/۰۳ (عمدتا MAH، 03SS، دم کردن واژینال و رکتوم)، بخشی از ۰۳ توسط آنتی اکسیدان های محیط حذف می شود. واکنش بیشتر ۰۳ با مولکولهای زیستی، آلدهید (به عنوان مثال، ۴-هیدروکسینوننال (۴-HNE)) و پراکسید (H202 و پراکسیدهای آلی) تولید میکند. این محصولات جانبی واکنش به عنوان پیام رسان های ثانویه عمل می کنند و پاسخ های هورمتیک تطبیقی بیشتری را القا می کنند [۵۶-۵۸]. اوزون در دوز درمانی “فقط” به عنوان تعدیل کننده یا پیش دارو عمل می کند و با القای پیام رسان های ثانویه، پاسخ های تطبیقی بعدی را افزایش می دهد [۲۱].
واسطه هایی مانند ۴-HNE و H202 از جمله مرتبط ترین پیام رسان های ثانویه ای هستند که اثرات مفیدی را در طول کاربردهای پزشکی ایجاد می کنند، آنها یک محرک اکسیداتیو تدریجی را القا می کنند که سنتز آنتی اکسیدان های درون زا مانند SOD، CAT و GPx را ایجاد می کند [۱۸،۵۹]. این واقعیت نشان می دهد که ۰۲/۰۳ یک درمان ضد اکسیدانی متناقض است که یک پاسخ آنتی اکسیدانی درون زا را فرا می خواند. علاوه بر این، مقادیر کم H202 تشکیل شده در نتیجه 02f03 نقش کلیدی در مکانیسم مولکولی دارند. H202 حیاتی و فعال کننده رایج مدولاسیون مسیرهای NF-KB و Nrf2 است [۶۰-۶۲]. علاوه بر این، ۴-HNE همچنین سیگنال استرس اکسیداتیو گذرا را ارسال می کند و اثرات آن به غلظت و همچنین منشاء سلول/بافت بستگی دارد. این مسیر می تواند سنتز چندین ماده مانند: y-گلوتامیل ترانسفراز، y-گلوتامیل ترانس پپتیداز، HSP-70، H0-1 و آنزیم های آنتی اکسیدانی مانند SOD، GPx، CAT و گلوکز-۶-فسفات دهیدروژناز را فعال سازد [۲۱] . علاوه بر این، این اثرات پرتوان ۴-HNE را می توان با برهمکنش های وابسته به غلظت آن با شبکه های سیتوکین و سیستم های آنتی اکسیدانی پیچیده سلولی که ویژگی های سلولی و بافتی را نشان می دهد توضیح داد [۵۹،۶۳].
نتایج تجربی نشان داد که اوزون در دوزهای درمانی خارج از بدن یا in vivo میتواند Nrf2 [20،۳۲] را فعال کند که شامل تعدیل (بازداری) غیرمستقیم مسیر NF-KB است. علاوه بر این، Nrf2 فعالیت NF-KB را با حذف ROS سرکوب می کند، که ممکن است موجب فعال سازی NF-KB از طریق القای پروتئین آنتی اکسیدانی مانند H0-1 و NQOl شود. علاوه بر این، Nrf2 فعالیت NF-KB را از طریق برخی از فعل و انفعالات پروتئین-پروتئین سرکوب می کند، و همچنین بیان ژن سیتوکین التهابی را از طریق اتصال مستقیم به پروموتور ژن آنها سرکوب می کند [۶۴].
مسیر NF-KB آزادسازی سیتوکین های پیش التهابی مانند: TNFcx، IFNy، 1Llf3، IL6، IL8، و همچنین ژن های پیش التهابی مانند سیکلواکسیژناز-۲ (COX-2) و نیتریک اکسید سنتاز القایی (iNOS) را فعال می کند [۶۵] . این مورد به خوبی شناخته شده است که تنظیم هر دو مسیر، NF-KB و Nrf2، شامل یک تداخل برای ایجاد یک پاسخ التهابی هماهنگ است [۶۶،۶۷]. تعدیل پاسخ التهابی توسط اوزون در یک کارآزمایی بالینی ۱ بر روی بیماران مبتلا به مولتیپل اسکلروزیس (ME) که با دمش رکتوم به مدت ۳۰ روز تحت درمان ۰۲/۰۳ قرار گرفتند، مشهود بود [۱۹]. با گرفتن داده های اصلی این دنباله و محاسبه مجدد مقادیر بر حسب نسبت فسفوریلاسیون Nrf2 (به عنوان شرح فعال شدن مسیر Nrf2) و IL-lf3 (همانطور که در مسیر NF-KB مشخص شده است) این مدولاسیون آشکار شد (شکل ۱). در بیماران مبتلا به ME بدون درمان، تعادل Nrf2/NF-KB به نفع فرآیند التهابی است و ۰۲/۰۳ تعادل آن مسیرها را بازیابی میکند.
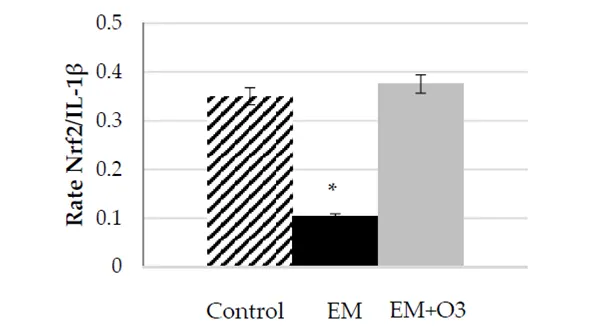
شکل ۱. Nrf2/IL-1 i3 را به عنوان نشانگرهای زیستی فعال شدن مسیر Nrf2/NF-KB تعادل بعد و قبل از درمان ۰۲/۰۳ در نظر بگیرید. گروه کنترل، داوطلبان سالم. EM، بیماران مبتلا به مولتیپل اسکلروزیس عودکننده- فروکش کننده با دوره های بدون تشدید بیماری. EM+ 03، بیماران مبتلا به مالتیپل اسکلروزیس پس از درمان 02f03 با دمش رکتوم به مدت ۳۰ روز (سه بار در هفته در طول یک ماه با دوز ۲۰ میکروگرم در لیتر). دادهها از دلگادو و همکاران، ۲۰۱۷ [۱۹] گرفته شد. مقادیر نشان دهنده میانگین ± S.E.M. از سه آزمایش مستقل (* p <0.05).
تجزیه و تحلیل فردی متغیر مورد سنجش در این مطالعه نشان داد که مقادیر Nrf2 در بیماران تحت درمان با اوزون در مقایسه با گروه کنترل (به ترتیب ۹۳/۰ در مقابل ۷۵/۰) افزایش قابل توجهی (۰۵/0p<) در مقادیر Nrf2 Nrf2 را نشان میدهد که مقادیر قابلتوجهی از Nrf2 از سطح پایه در بیماران ME (0.56 واحد تراکم سنجی) را بازیابی میکند. افزایش Nrf2 مطابق با کاهش قابل توجه ۶۱ درصد از سطح سیتوکین التهابی IL-1 f3 در بیماران تحت درمان با ME در مقایسه با سطوح پایه بود، حتی سطوح IL-1 f3 در ME ، ۹۴ درصد بیشتر از مقادیر باقی می ماند. در موضوعات عادی
عدم تعادل بین Nrf2/NF-KB در بیماریهای دیگری مانند نوروپاتی دیابتی [۶۸] پیشنهاد شده است که در آن اوزون بطور تجربی کارایی خود را در متعادل سازی این اختلال نشان داده است [۶۲]. روندهای مشابهی در بیماریهای ویروسی یافت شد، مسیرهای NF-KB میتوانند از عفونت ویروس آنفولانزای A حمایت کنند و باعث افزایش ذاتالریه شوند. از طریق فعال سازی سیگنال Nrf2، برخی از داروها به عنوان امودین می توانند میزان بقا را افزایش داده، بیماری های ریه، تیتر ویروسی ریوی و سایتوکاین های التهابی را کاهش دهند و تغییرات هیستوپاتولوژیک ریه را بهبود بخشند [۶۹]. علاوه بر این، نشان داده شده است که ویروس بیماری خونریزی دهنده خرگوش (که باعث هپاتیت برق آسای کشنده در خرگوش ها می شود) یک مکانیسم پاتولوژیک دارد که شامل سرکوب مسیر Nrf2 است [۷۰].
اوزون تراپی و محافظت سلولی
آنتی اکسیدان ها برای حفظ یکپارچگی سلولی و محافظت سلولی مهم هستند.
تعدیل در سطح Nrf2/NF-KB، ۰۲/۰۳ نه تنها سیستم آنتی اکسیدانی درون زا را افزایش می دهد، بلکه بیان سایتوکاین های پیش التهابی را تعدیل می سازد و روی محافظت سلولی تأثیر می گذارد. COVID-19 مجاری تنفسی فوقانی و تحتانی را آلوده می کند و باعث سندرم تنفسی خفیف تا بسیار حاد می گردد و در نتیجه موجب بروز بیش از حد سیتوکین های پیش التهابی از جمله اینترلوکین IL-1 f3 و IL-6 می شود. فعالسازی گیرندههای شبه تلفات توسط SARS Cov-2 RNA منجر به آزاد شدن pro-IL-1 f3 میشود که توسط کاسپاز-۱ جدا میشود و به دنبال آن فعالسازی التهابی و تولید IL-lf3 بالغ فعال میشود که واسطه التهاب ریه ، تب و فیبروز است [۷۱].
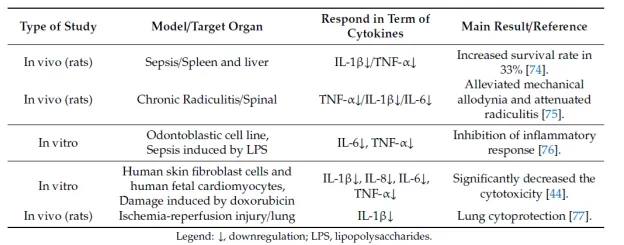
با این حال، نشان داده شده است که سرکوب و نه کاهش خانواده IL-1 پیش التهابی و IL-6 در بسیاری از بیماری های التهابی، از جمله عفونت های ویروسی، موش های فاقد بیان سیگنال IL-1، افزایش تکثیر ویروسی، ویروس کرونا [۷۲] اثر درمانی دارند. علاوه بر این، موشهای دارای کمبود IL-6 آلوده به ویروس آنفولانزا، کشندگی بالاتر، کاهش وزن بدن و تجمع فیبروبلاست بالاتر و گردش ماتریکس خارج سلولی (ECM) کمتری در ریهها نسبت به همتایان نوع وحشی خود نشان دادند [۷۳]. Inflammasome، یک مجموعه پروتئین سیتوزولی که واسطه پردازش و ترشح سیتوکین های پیش التهابی است، یکی از اولین پاسخ دهنده ها در طول عفونت ویروسی است. سیتوکین های ترشح شده به دنبال فعال شدن التهاب، سلول های سیستم ایمنی ذاتی و سازگار را تنظیم می کنند و پاسخ های ایمنی بعدی را هدایت می کنند. بنابراین، نه سرکوبکننده، بلکه تعدیلکننده سیتوکینها ممکن است تأثیر مؤثری در سمیت سلولی حیاتی داشته باشد. دادههای نماینده درباره کاهش تنظیمشده سیتوکینهای IL-1 f3، IL-6، IL-8 و TNF-cx در جدول ۱ نشان داده شده است.
جدول ۱. اثر (اوزون درمانی با روش سالین DIV هاوارد رابینس به عنوان تعدیل کننده سیتوکین های پیش التهابی.
بیان پاسخ سیتوکین به سیگنال قبلی ارتباط نزدیکی با عملکرد عوامل هسته ای دارد. یک بررسی آزمایشگاهی، که در قلب و فیبروبلاست های پوست انجام شد، نقش اوزون القا شده توسط دوکسوروبیسین را در سطح Nrf2 و NF-KB تجزیه و تحلیل کرد [۴۴]. نویسندگان نقش فردی دوزهای مختلف اوزون را در این مدل تجزیه و تحلیل کردند. تجزیه و تحلیل مجدد این داده ها، با محاسبه نرخ NF-KB/Nrf2، کاهش آشکار اثر اوزون اما نه سرکوب را نشان داد (شکل ۲). همین روند در کشت فیبروبلاست های پوستی تحت درمان با دوکسوروبیسین و ۰۲/۰۳ نیز مشاهده شد.
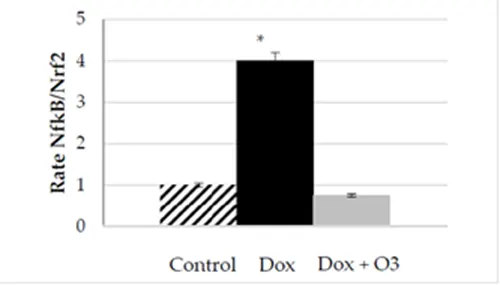
شکل ۲. نرخ مقادیر تغییر برابری NF-KB/Nrf2 به عنوان شاخص تعادل فعال شدن مسیر NF-KB/Nrf2 با و بدون درمان ۰۲/۰۳. کنترل، کشت کاردیومیوسیت. داکس، سلول ها به علاوه دوکسوروبیسین (۱۰۰ نانومولار)؛ Dox + 03، سلول درمان شده با دوکسوروبیسین (۱۰۰ نانومولار) و اوزون ۴۰ میکروگرم بر میلی لیتر. دادهها از Simonetti و همکاران، ۲۰۱۹ [۴۴] گرفته شد. مقادیر نشان دهنده میانگین ± S.E.M. از سه آزمایش مستقل (* p <0.01) هستند.
تجزیه و تحلیل مقادیر فردی نشان داد که بازیابی تعادل NF-KB/Nrf2 اساساً با حفظ سطح Nrf2 در سلولهای درمان شده با اوزون (به ترتیب در گروه کنترل ۰.۸ در مقابل ۰.۹ برابر شانس) در مقایسه با مقادیر کاهش یافته Nrf2 مشاهده شده در سلول های درمان شده با دوکسوروبیسین (۰.۵ برابر شانس، با توجه به کشت سلولی کنترل) حاصل شد. این حفظ سطح Nrf2 از افزایش ۱۰۰ درصدی NF-KB که در طول درمان با دوکسوروبیسین رخ می دهد، جلوگیری می کند. آزمایش نشان داد که مداخله با اوزون، حقایق ضروری Nrf2 را برای جلوگیری و تنظیم NF-KB حفظ می کند.
پاسخ هورمتیک، آماده سازی اکسیداتیو یا سازگاری با استرس اکسیداتیو مزمن، در طول OT، اکنون به صورت تجربی نشان داده شده است [۷۸]. مفهوم دوز در OT بسیار قابل توجه است، مسیر تجویز و پروتکل های بالینی نیز مهم هستند. در دوزهای بالاتر، اثر توصیف شده اوزون می تواند به شدت تغییر کند. دوزهای بالای اوزون باعث رونویسی ژن سیتوکین پیش التهابی، گیرنده آن و پروتئین های التهابی می شود. در همان زمان، آنها تنظیم منفی اینترفرون نوع ۱ و پاسخ به مسیرهای عفونت های ویروسی را فراخوانی می کنند [۷۹].
راه های تجویز سیستمیک توصیه شده عبارتند از: 03SS، MAH و اکسیژن رسانی-اوزون زنی خارج بدنی خون (EBOO). پروتکل های بالینی باید با دوزها و روش های استاندارد تعریف شده در بیانیه مادرید OT [16] مطابقت داشته باشد. حداقل سه کارآزمایی بالینی با استفاده از اتوهمتراپی عمده در چین در حال انجام است و آزمایشهای بالینی بیشتری برای تأیید اثربخشی OT به عنوان درمان مکمل در درمان بیماریهای COVID-19 مورد نیاز می باشد. این یک درمان مکمل است زیرا در حالی که بیمار مبتلا با داروی آلوپاتیک درمان می شود، در عین حال بیمار درمان تکمیلی پیشنهادی را نیز دریافت می کند. لازم به ذکر است که حتی اگر اوزون هیچ تاثیری بر عفونت ویروسی نداشته باشد، تعدیل نشان داده شده استرس اکسیداتیو و سایتوکین های التهابی توسط (اوزون درمانی با روش سالین DIV هاوارد رابینس می تواند یک اثر بالینی مرتبط و مفید در پی داشته باشد. علاوه بر این، تأثیر کوچکی در نیازمندیهای روزهای بستری، بهویژه در بخشهای مراقبتهای ویژه، میتواند منجر به سود بالایی در شرایط بحرانی کنونی شود که بسیاری از کشورها از آن رنج میبرند.
نتیجه گیری ها
OT سیستمیک می تواند به طور بالقوه در SARS-CoV-2 مفید باشد. منطق و مکانیسم عمل قبلاً از نظر بالینی با سایر عفونت های ویروسی ثابت شده است و در مطالعات تحقیقاتی بسیار مؤثر است. مکانیسم های عمل درگیر عبارتند از مدولاسیون مسیر NF-KB/Nrf2 و بیان IL-6/IL-lf3. مدولاسیون این مسیرها توسط OT در cytoptotection و انسداد تکثیر ویروس تأثیر دارد. آزمایشات بالینی آینده برای اثبات استفاده مکمل از OT در COVID-19 مورد نیاز است.
خلاصه
ظهور بیماری سندرم حاد تنفسی ویروس کرونا ۲ (SARS-CoV-2) (COVID-19) در چین در پایان سال ۲۰۱۹ زمینه ساز شیوع گسترده جهانی شده است. (اوزون درمانی با روش سالین DIV هاوارد رابینس سیستمیک (OT) می تواند به طور بالقوه در مدیریت بالینی چندین عارضه ثانویه در حوزه SARS-Co V-2 مفید باشد. منطق و مکانیسم عمل قبلاً از نظر بالینی در سایر عفونت های ویروسی به اثبات رسیده است و در مطالعات تحقیقاتی نشان داده شده است که در کاهش آسیب اندام ناشی از التهاب و استرس اکسیداتیو بسیار مؤثر است. این بررسی، مطالعات OT را خلاصه میکند که مکانیسم احتمالی محافظت سلولی اوزون و محصولات جانبی فیزیولوژیکی آن را در مورد اندامهای هدف تحت تأثیر SARS-CoV-2 نشان میدهد.
این ارائه در مجموع ۷۴ مقاله اصلی بررسی شده را در بر میگیرد. این بررسی عمدتا بر روی اوزون به عنوان تعدیل کننده مسیرهای NF-KB/Nrf2 و بیان IL-6/IL-lf3 متمرکز است. در مدلهای تجربی و معدود مطالعات بالینی موجود، هموستاز تعادل رادیکالهای آزاد و آنتیاکسیدانی توسط OT با تعدیل تعادل NF-KB/Nrf2 و بیان IL-6 و IL-lf3 همراه بود. این مکانیسمهای مولکولی از اثرات سیتوپروتکتیو OT در برابر آسیب بافتی موجود در بسیاری از بیماریهای التهابی، از جمله عفونتهای ویروسی، پشتیبانی میکنند. نقش بالقوه محافظت سلولی OT در مدیریت آسیب اندام ناشی از COVID-19 نیازمند تحقیقات بیشتر می باشد و آزمایشات بالینی کنترل شده مورد نیاز است.
می توانید متن کامل و ادامه مقاله را در فایل PDF مطالعه کنید.

