مقدمه
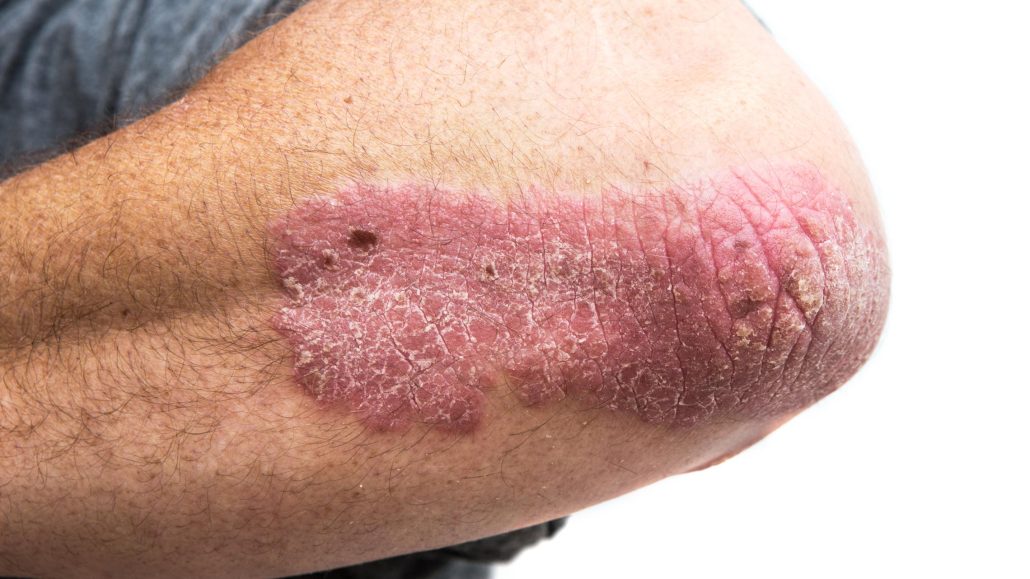
داروهای موضعی یکی از درمانهای اصلی برای پسوریازیس ولگاریس موضعی هستند. گلوکوکورتیکوئیدهای موضعی با شروع سریع و اثربخشی خوب در درمان پسوریازیس ولگاریس مشخص میشوند [۱]. با این حال، استفاده طولانی مدت ممکن است منجر به عوارض جانبی مانند آتروفی پوست، اتساع مویرگی، پورپورا، هیرسوتیسم و فولیکولیت شود [۲]. ازن (O3) مولکولی متشکل از سه اتم اکسیژن با قدرت اکسیدکنندگی قوی است. ازن دارای اثرات ضد عفونی، تسریع متابولیسم خون، ضد التهابی [۳] و تعدیل کننده سیستم ایمنی [۴] است و میتواند به طور گسترده در درمان درماتیت آتوپیک، زخمهای عفونی، اختلالات گردش خون، روماتیسم، تومورها، سندرم حاد تنفسی شدید (SARS) و سندرم نقص ایمنی اکتسابی (AIDS) [5-6] مورد استفاده قرار گیرد. با این حال، ازن میتواند در دمای اتاق به اکسیژن تجزیه شود. برای تهیه روغن ازن جهت استفاده راحت، باید در روغن نباتی حل شود. این مطالعه از پماد فلومتازون مرکب به عنوان گروه کنترل برای بررسی اثربخشی بالینی و ایمنی روغن ازون در درمان بیماران مبتلا به پسوریازیس ولگاریس موضعی پایدار استفاده کرد.
۱ مواد و روشها
۱.۱ دادههای بالینی
در مجموع ۴۰ بیمار مبتلا به پسوریازیس که از آوریل ۲۰۱۶ تا آوریل ۲۰۱۷ به درمانگاه سرپایی بیمارستان سوم شیانگیا در دانشگاه مرکزی جنوبی مراجعه کرده بودند، شامل ۲۲ مرد و ۱۸ زن، ثبت نام شدند. سن بیماران از ۱۹ تا ۶۸ سال (۴۲.۶ ± ۱۲.۵) سال و دوره بیماری از ۵ تا ۳۶ ماه (۱۱.۶ ± ۹.۳) ماه متغیر بود. معیارهای ورود: بیماران ۱۸ سال یا بالاتر؛ بیمارانی که معیارهای تشخیص بالینی پسوریازیس ولگاریس (فاز پایدار) را دارند و ضایعات پوستی آنها کمتر از ۳۰٪ از کل سطح بدن را تشکیل میدهد. بیمارانی که ضایعات پوستی در سمت چپ و راست بدنشان به صورت متقارن توزیع شده و ضایعات پوستی روی اندامها دارند. معیارهای خروج: ۱) بیمارانی که در حال حاضر مبتلا به پسوریازیس فعال از نوع خالدار، پوسچولار یا اریترودرمیک هستند؛ ۲) بیمارانی که ضایعات پوستی آنها بیش از ۳۰٪ از کل سطح بدن را تشکیل میدهد یا بیمارانی که پسوریازیس شدید دارند و نیاز به درمان سیستمیک دارند؛ ۳) بیمارانی که عفونتهای موضعی باکتریایی، ویروسی، قارچی یا انگلی در ضایعات پوستی دارند؛ ۴) بیمارانی که حساسیت شناخته شده یا مشکوک به اجزای داروی مورد مطالعه دارند. ۵) بیمارانی که نارسایی کلیوی، بیماری کبدی یا بیماری قلبی شدید شناخته شده یا مشکوک دارند؛ ۶) بیماران مبتلا به بیماریهای عصبی-روانی و بیماریهای شدید غدد درونریز؛ ۷) بیمارانی که ظرف ۴ هفته قبل از درمان، درمان سیستمیک دریافت کردهاند یا ظرف ۲ هفته قبل از درمان، گلوکوکورتیکوئیدها یا سایر داروهای موضعی پسوریازیس را مصرف کردهاند؛ ۸) زنانی که باردار بودند یا در سن باروری بودند و در طول مطالعه تمایل به بارداری داشتند، یا زنانی که به نوزاد خود شیر میدادند. بیماران داوطلبانه شرکت کردند و رضایتنامه آگاهانه را امضا کردند.
۱.۲ روشها
۱.۲.۱ درمان
یک آزمایش خودکنترلی انجام شد که در آن بیماران دارای ضایعات سمت چپ به عنوان گروه آزمایش و بیماران دارای ضایعات سمت راست به عنوان گروه کنترل در نظر گرفته شدند. گروه آزمایش، روغن اوزون (با نام تجاری روغن هایژی، ۱۵ میلیلیتر در هر بطری، اهدایی شرکت فناوری پزشکی هونان هایژی) را دو بار در روز، صبح و عصر استفاده کردند. گروه کنترل با پماد فلومتازون ترکیبی (۱۵ گرم در هر تیوب، حاوی ۰.۲ میلیگرم در هر گرم فلومتازون، تولید کارخانه داروسازی Aome و خریداری شده از داروخانه بیمارستان سوم شیانگیا از دانشگاه مرکزی جنوبی) دو بار در روز، صبح و عصر، تحت درمان قرار گرفت و دوره درمان ۴ هفته بود. ۱.۲.۲ تحلیل اثربخشی و ایمنی شاخص شدت بیماری (PASI) بر اساس شدت ضایعات پوستی (A)، اریتم (R)، نفوذ (T) و پوستهریزی (S) در محل درمان امتیازدهی شد. روش امتیازدهی اصلاحشده PASI برای محاسبه مساحت ضایعه، درجه اریتم، نفوذ و پوستهریزی (۰ برای هیچ، ۱ برای خفیف، ۲ برای متوسط، ۳ برای شدید و ۴ برای بسیار شدید) قسمتهای متقارن آزمایششده اندام فوقانی (u)، تنه (t) و اندام تحتانی (l) استفاده شد و نمره کل برای هر ناحیه آسیبدیده پس از اصلاح با استفاده از ضریب ناحیه آسیبدیده (۰.۲ برای اندام فوقانی، ۰.۳ برای تنه و ۰.۴ برای اندام تحتانی) به دست آمد. فرمول PASI=0.2(Ru+Tu+Su)Au+0.3(Rt+Tt+St)At+0.4(Rl+Tl+Sl)Al بود. نمرات PASI قبل از درمان و ۱، ۲ و ۴ هفته پس از درمان محاسبه شد و درصد کاهش PASI در ضایعات هدف در مکانهای متقارن پس از ۱، ۲ و ۴ هفته درمان مقایسه شد. تجزیه و تحلیل فراوانی روی بیمارانی انجام شد که نمرات PASI آنها در مقایسه با حالت پایه پس از ۴ هفته درمان، ≥۵۰%، ≥۷۵% و ≥۹۰% کاهش یافته بود. کاهش ≥۷۵ درصدی نمرات PASI پس از درمان، مؤثر در نظر گرفته شد. همزمان، از یک میکروسکوپ کانفوکال بازتابی (RCM) برای مشاهده تغییرات ضایعات پوستی هدف قبل و بعد از درمان استفاده شد.
۱.۲.۳ مشاهده واکنش نامطلوب
مشاهده و ثبت واکنشهای نامطلوب رخ داده در طول آزمایش، از جمله واکنشهای نامطلوب دارویی پس از درمان موضعی، مانند علائم تحریک مانند اریتم، آتروفی پوست، اتساع مویرگی، تغییرات رنگدانه، فولیکولیت، علائم آلرژیک و علائم و نشانههای سیستمیک.
۱.۳ تحلیل آماری
برای تجزیه و تحلیل از نرمافزار آماری SPSS 17.0 استفاده شد. دادههای اندازهگیری به صورت میانگین ± انحراف معیار (x ± s) بیان شدند. دادههای دو گروه در مقاطع زمانی مختلف با استفاده از آزمون تحلیل واریانس با اندازهگیری مکرر تجزیه و تحلیل شدند. فراوانی بیمارانی که نمرات PASI آنها در مقایسه با حالت پایه پس از ۴ هفته درمان، ≥۵۰%، ≥۷۵% و ≥۹۰% کاهش یافته بود، بین دو گروه با آزمون χ۲ مقایسه شد. P < 0.05 از نظر آماری معنیدار در نظر گرفته شد.
۲. نتایج
۲.۱ اثربخشی بالینی
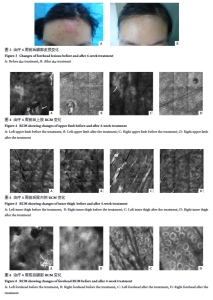
قبل از درمان، برخی از بیماران اریتم، پلاکها، نفوذ و پوستهریزی متقارن و واضحی در اندامهای فوقانی، فرج، قسمت داخلی ران، پیشانی و غیره داشتند. پس از ۴ هفته درمان، اریتم، پلاکها، نفوذ و پوستهریزی در هر دو طرف آزمایش و کنترل اساساً فروکش کرده بود و مقداری رنگدانه باقی مانده بود (شکلهای ۱-۳). بررسیهای RCM برخی از بیماران قبل از درمان نشان داد: آکانتوز در ناحیه ضایعه، ارتشاح سلولهای التهابی در اطراف رأس پاپیلای پوستی و رگهای خونی، و تشکیل میکروآبسههای مونرو یا جوشهای چرکی اسفنجی شکل. RCM در سمت مورد آزمایش و کنترل پس از ۴ هفته درمان نشان داد که اپیدرم ناحیه ضایعه به طور کلی طبیعی است و مقدار کمی نفوذ سلولهای التهابی در پاپیلای پوستی وجود دارد که در مقایسه با قبل از درمان به طور قابل توجهی کاهش یافته است.
۲.۱.۱ بهبود نمره PASI
هر ۴۰ مورد، ۴ هفته مشاهده و ارزیابی را به پایان رساندند. درصد کاهش نمره PASI در گروه آزمایش در پایان هفته اول درمان کمتر از گروه کنترل بود (P<0.05)؛ تفاوت معنیداری در درصد کاهش PASI بین دو گروه در پایان هفته دوم و چهارم درمان وجود نداشت (۰.۰۵<P، جدول ۱). ۲.۱.۲ مقایسه میزان مؤثر پس از درمان یک هفته پس از درمان، میزان مؤثر گروه آزمایش و گروه کنترل به ترتیب ۶۰.۵۸٪ و ۷۲.۲۸٪ بود و این تفاوت از نظر آماری معنیدار بود (P<0.05). دو هفته پس از درمان، میزان اثربخشی گروه آزمایش و گروه کنترل ۶۹.۸۴٪ و
تفاوت از نظر آماری معنیدار نبود.
پس از ۴ هفته درمان، نمره PASI گروه آزمایش در مقایسه با شروع درمان، ۵۰٪ یا بیشتر کاهش یافت.
فراوانی بیماران با ≥۷۵٪ و ≥۹۰٪ به ترتیب ۳۷، ۳۰ و ۱۲ نفر بود.
تعداد بیماران در گروه کنترل به ترتیب ۳۸، ۳۱ و ۱۲ نفر بود و تفاوت آماری معنیداری بین دو گروه وجود نداشت.
(۰.۰۵>P).
۲.۲ واکنشهای جانبی
در گروه آزمایش، ۲ مورد دچار خارش و ۳ مورد دچار هیپوپیگمانتاسیون شدند. در گروه کنترل، ۳ مورد دچار فولیکولیت و ۵ مورد دچار هیپوپیگمانتاسیون شدند که پس از قطع دارو برطرف شدند. هیچ عارضه جانبی جدی در بین همه افراد مشاهده نشد.
۳ بحث
نتایج این مطالعه نشان داد که یک هفته پس از درمان، میزان مؤثر روغن ازن و فلومتازون ترکیبی به ترتیب ۶۰.۵۸٪ و ۷۲.۲۸٪ بود که تفاوت آماری معنیداری داشتند (P<0.05). شروع اثر روغن ازون کندتر از پماد فلومتازون کامپاند است، که به این واقعیت مربوط میشود که پماد فلومتازون کامپاند یک داروی گلوکوکورتیکوئیدی با شروع اثر سریع است. پس از ۲ هفته درمان، میزان اثربخشی دو گروه به ترتیب ۶۹.۸۴٪ و ۷۰.۲۵٪ بود. پس از ۴ هفته، نرخهای مؤثر به ترتیب ۷۰.۸۸٪ و ۷۱.۲۳٪ بودند. تفاوت معنیداری وجود نداشت (P>0.05)، که نشان میدهد اثربخشی روغن ازون در درمان پسوریازیس مشابه پماد فلومتازون کامپاند است. پس از ۴ هفته درمان با روغن ازن و پماد فلومتازون ترکیبی، نتایج RCM نشان داد که اپیدرم به طور کلی طبیعی است و مقدار کمی نفوذ سلولهای التهابی در پاپیلای پوستی وجود دارد. RCM مشاهده کرد که میزان نفوذ سلولهای التهابی در مقایسه با قبل از درمان به طور قابل توجهی کاهش یافته است، که نشان میدهد روغن ازون همان اثر ضد التهابی گلوکوکورتیکوئیدها را دارد. علاوه بر این، تنها ۲ مورد در گروه آزمایش پس از مصرف دارو، واکنشهای تحریک موضعی مانند خارش را تجربه کردند و هیچ عارضه جانبی جدی رخ نداد که نشان میدهد این دارو نسبتاً بیخطر بوده است. پسوریازیس یک بیماری التهابی مزمن و عودکننده پوستی است که در آن سلولهای ایمنی متعددی درگیر میشوند. علت و پاتوژنز آن پیچیده است، اما هسته اصلی آن اختلال عملکرد سیستم ایمنی است. اختلال عملکرد سیستم ایمنی، عمدتاً سلولهای T، نقش مهمی در بروز و توسعه این بیماری دارند. مطالعات قبلی[۷] تأیید کردهاند که در پاتوژنز پسوریازیس، عدم تعادل در تعادل سلولهای Th1/Th2 وجود دارد. مطالعات اخیر[۸] نشان دادهاند که سلولهای Th17 و Treg نیز نقش مهمی در پاتوژنز پسوریازیس دارند. مطالعات[۹] نشان دادهاند که اختلال عملکرد سلولهای Treg منجر به کاهش عملکرد مهاری آنها میشود و در نتیجه باعث پسوریازیس میگردد. علاوه بر این، شواهد بالینی نیز ثابت میکند که وقوع پسوریازیس ارتباط نزدیکی با عفونت دارد. حجم زیادی از دادههای بالینی [۱۰-۱۱] نشان میدهد که باکتریها میتوانند باعث پسوریازیس شوند. استافیلوکوکوس اورئوس در پوست بیماران پسوریازیس ساکن میشود و شروع و تشدید پسوریازیس با عفونت استرپتوکوکی مرتبط است. ازن به طور گسترده در درمان درماتیت آتوپیک، زخمهای عفونی، اختلالات گردش خون، دژنراسیون ماکولا، روماتیسم، تومورها، سارس و ایدز مورد استفاده قرار گرفته است [۵-۶]. تحقیقات [۵] همچنین نشان داد که ازن دارای اثر تعدیلکننده سیستم ایمنی است: ازن میتواند باعث آزادسازی IL-10، TGF-β و غیره شود. IL-10 و TGF-β سیتوکینهای سرکوبکننده سیستم ایمنی هستند که عمدتاً توسط سلولهای Treg ترشح میشوند. IL-10 و TGF-β اثرات مهاری بر روی هر دو Th1 و Th2 دارند. این مطالعه مشاهده کرد که روغن ازون در درمان پسوریازیس مؤثر است و RCM نشان داد که میزان نفوذ سلولهای التهابی در مقایسه با قبل از درمان به طور قابل توجهی کاهش یافته است. گمان میرود که یکی از مکانیسمهای روغن ازون در درمان پسوریازیس ممکن است مربوط به سلولهای Treg القا شده توسط ازون باشد که سیتوکینهای سرکوبکننده سیستم ایمنی مانند IL-10 و TGF-β را ترشح میکنند، که ارتباط نزدیکی با اثرات ضد عفونی و ضد التهابی ازون دارد. این مطالعه روش کنترل خود-راست و چپ-راست را اتخاذ کرد که میتواند خطاهای آماری ناشی از تفاوتهای فردی مانند سن، جنسیت و مرحله بیماری را از بین ببرد. این مطالعه نشان داد که روغن ازون در درمان پسوریازیس مؤثر است، عوارض جانبی کمی دارد و استفاده از آن آسان است. با این حال، حجم نمونه کوچک است و برای تأیید این موضوع، یک مطالعه بالینی دوسوکور موازی کنترلشده با حجم نمونه بزرگتر مورد نیاز است. بیانیه تضاد منافع: نویسندگان هیچگونه تضاد منافعی را اعلام نمیکنند.
منابع
[۱] Kimball AB, Jacobson C, Weiss S, et al. The psychosocial burden of
psoriasis[ J]. Am J Clin Dermatol, 2005, 6(6): 383-392.
[۲] Sugarman JL, Gold LS, Lebwohl MG, et al. Phase 2, multicenter,
double-Blind, randomized, vehicle controlled clinical study to assess
the safety and efficacy of a halobetasol/tazarotene fixed combination
in the treatment of plaque psoriasis[ J]. J Drugs Dermatol, 2017,
۱۶(۳): ۱۹۷-۲۰۴.
[۳] Ozturk B, Kurtoglu T, Durmaz ST, et al. The effects of ozone on
bacterial growth and thiol-disulphide homeostasis in vascular graft
infection caused by MRSA in rats[ J]. Acta Cir Bras, 2017, 32(3):
۲۱۹-۲۲۸.
[۴] Bocci V. Biological and clinical effects of ozone. Has ozone therapy a
future in medicine[ J]. Br J Biomed Sci, 1999, 56(4): 270-279.
[۵] 张英博, 向亚平, 黄进华, 等. 联合臭氧水治疗特应性皮炎患者
的疗效及白细胞介素۴、神经生长因子检测[ J]. 中华皮肤科
杂志, ۲۰۱۶, ۴۹(۱۰): ۷۳۶-۷۳۸.
ZHANG Yingbo, XIANG Yaping, HUANG Jinhua, et al. Combined
ozone hydrotherapy for atopic dermatitis: evaluation of efficacy and
detection of interleukin-4 andnerve growth factor levels in peripheral
blood from patients before and after treatment[ J]. Chinese Journal
of Dermatology, 2016, 49(10): 736-738.
[۶] Elvis AM, Ekta JS. Ozone therapy: A clinical review[ J]. J Nat Sci Biol
Med, 2011, 2(1): 68-70.
[۷] Deng Y, Chang C, Lu Q. The inflammatory response in psoriasis: a
comprehensive review[ J]. Clin Rev Allergy Immunol, 2016, 50(3):
۳۷۷-۳۸۹.
[۸] Richetta AG, Mattozzi C, Salvi M, et al. CD4+ CD25+ T-regulatory
cells in psoriasis. Correlation between their numbers and biologics-
induced clinical improvement[ J]. Eur J Dermatol, 2011, 21(3): 344-
۳۴۸.
[۹] Zhang L, Li Y, Yang X, et al. Characterization of Th17 and FoxP3(+)
Treg cells in paediatric psoriasis patients[ J]. Scand J Immunol, 2016,
۸۳(۳):۱۷۴-۱۸۰.
[۱۰] 马天, 姜文成, 陈洁, 等. 银屑病发病机制研究进展[ J]. 中华临
床医师杂志, ۲۰۱۳, ۷(۲۱): ۹۶۵۶-۹۶۵۸.
MA Tian, JIANG Wencheng, CHEN Jie, et al. Research progress of
pathogenesis of psoriasis[ J]. Chinese Journal of Clinicians, 2013,
۷(۲۱): ۹۶۵۶-۹۶۵۸.
[۱۱] 魏迎亮, 郑兰艳. β-溶血型链球菌与银屑病发病、发生及发展
的研究现状[ J]. 微生物学杂志, ۲۰۱۲, ۳۲(۴): ۷۲-۷۴.
WEI Yingliang, ZHENG Lanyan. Current situation β-hemolytic
streptococci and the mobidity, genesis and development of
psoriasis[ J]. Journal of Microbiology, 2012, 32(4): 72-74