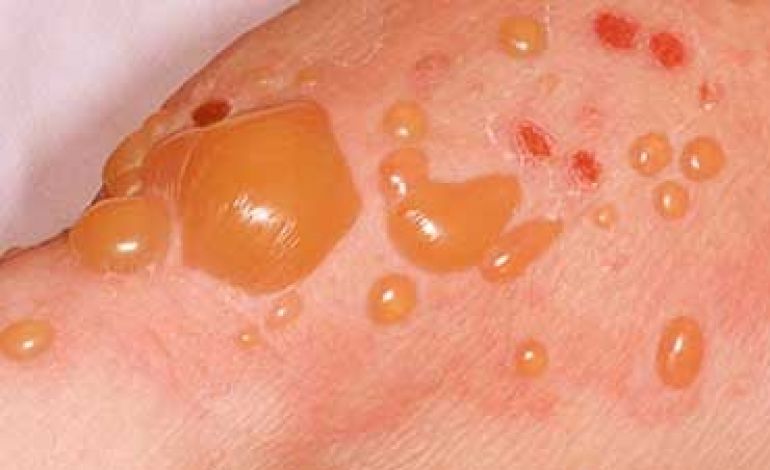
شکل ۲. پمفیگوس وولگاریس
A. پمفیگوس وولگاریس،تاول های شلی رانشان می دهد که به راحتی پاره می شوند ، و باعث اروزیون های متعدد و پلاک های کراسته می شوند. B. پمفیگوس وولگاریس تقریباٌ همیشه مخاط دهان را گرفتار می کند و ممکن است اروزیون هایی در لثه ، مخاط بوکال، کام ، پشت حلق یا زبان وجود داشته باشد.
بیماران دچار مراحل اولیه PV پیشرفته (به عبارت دیگر ، بیماری مخاطی جلدی) اتوآنتی بادی های IgG علیه هر دو Dsg3 وDsg1 دارند. مطالعات تجربی نشان داده اند که اتوآنتی بادی های بیماران مبتلا به PV پاتوژنیک هستند (به عبارتی دیگر مسئول ایجاد تاول هستند) و تیتر آنها با فعالیت بیماری ارتباط دارد. مطالعات اخیرنشان داده اند که پروفایل اتوآنتی بادی علیه Dsg در سرم این بیماران و توزیع بافتی Dsg3 و Dsg1 ، محل تشکیل تاول دربیماران مبتلا به پمفیگوس را مشخص می کند . بیان همزمان سلول های Dsg1 و Dsg3 توسط سلول های اپیدرمی از این سلول ها درمقابل IgG پاتوژیک اگزوژن محافظت می کند اما در مقابل اتوآنتی بادی های غیرپاتوژنیک ضد آنها محافظتی به عمل نمی آورد .
PV می تواند تهدید کننده حیات باشد . پیش ازدر دسترس قرارگرفتن گلوکوکورتیکوئیدها ، مورتالیتی ۹۰ – ۶۰% بود ، مورتالیتی درحال حاضر حدود ۵% است. علل شایع موربیدیتی و مورتالیتی عفونت و عوارض درمان یا گلوکوکورتیکوئیدها هستند. عوامل پیش آگهی بد شامل سن بالا، درگیری وسیع و نیاز به دوز بالای گلوکوکورتیکوئیدها (با یا بدون عوامل تضعیف کننده ایمنی) برای کنترل بیماری هستند. سیر PV در بیماران متغیر و غیرقابل پیش بینی است. برخی بیماران به بهبودی می رسند ، در حالی که بقیه ممکن است نیاز به درمان طولانی مدت پیدا کنند یا در اثر عوارض بیماری یادرمان آن از پا در آیند. پایه درمانی اصلی گلوکوکورتیکوئیدهای سیستمیک هستند. در بیماران دچار PV متوسط تا شدید معمولا پردنیزولون، 1mg/kg روزانه شروع می شود . اگر ۲-۱ هفته بعد از درمان ضایعات جدید ظهور یابند ، دوز دارو ممکن است نیاز به افزایش و یا ترکیب با سایر عوامل ایمونو ساپرسیو مثل آزاتیوپرین روزانه (۲-۲/۵ mg/kg روزانه) یا سیکلوفسفامید( mg/kg 1-2 روزانه) و یا مایکوفنولات موفتیل (۲۰-۳۵ mg/kg روزانه) داشته باشد . بیماران دچار بیماری شدید مقاوم به درمان ممکن است از پلاسمافرز {شش تعویض با حجم زیاد (به عبارت دیگر ، L 3-2 در هر بار تعویض) طی حدود دو هفته}، ایمونوگلوبولین IV یا { IVIG } که ( 2g/kg طی ۳-۵ روز هر ۶-۸ هفته) ، یا ریتوکسی ماب ( 375mg به ازای هر متر مربع سطح بدن تا چهار هفته یا 1000mg در روزهای ۱ و ۱۵) سود ببرند. حائز اهمیت است که بیماری شدت یا پیشروند را سریعاٌ تحت کنترل قرار دهیم تا شدت و یا مدت این اختلال کاهش یابد . درنتیجه برخی پیشنهادکرده اند که ریتوکسی ماب وگلوکورتیکوئیدهای روزانه را باید در مراحل اولیه در بیماران PV استفاده کرد تا از گسترش بیماری مقاوم به درمان جلوگیری شود.
پمفیگوس فولیاسه
پمفیگوس فولیاسه ( PF ) توسط چند ویژگی از PV افتراق داده می شود. در PF تاول های آکانتولیتیک درون قسمت بالایی اپیدرم ، معمولا درست زیر استراتوم کورنئوم قرار گرفته اند . بنابراین PF یک بیماری تاولی سطحی تر نسبت به PV است. توزیع ضایعات در دو اختلال مشابه است ، به استثنای اینکه در PF تقریباً هیچ وقت غشاهای مخاطی درگیر نمی شوند . بیماران مبتلا به PF ندرتاً تاول های سالم دارند اما بیشتر اروزیون های همراه با اریتم، پوسته و تشکیل کراست نشان می دهند. موارد خفیف PF با درماتیت سبوره شدید مشابه هستند ، PF شدید ممکن است باعث پوسته ریزی گسترده شود . مواجهه با آفتاب (تابش ماوراء بنفش) ممکن است یک عامل تشدید کننده باشد. بیماران دچار PF ویژگی های ایمونوپاتولوژیک مشترک با PV دارند. به طور اختصاصی، میکروسکوپ ایمونوفلورسانس مستقیم از پوست پیش از ایجاد ضایعات رسوب، IgG روی سطح کراتینوسیت ها را نشان می دهد. به طور مشابهی، بیماران دچار PF اتوآنتی بادی های IgG در گردش علیه کراتینوسیت های سطحی دارند. در PF اتوآنتی بادی ها مستقیماٌ علیه Dsg1، یک کادهرین دسموزومی 160kDa هستند. این اتوآنتی بادی ها می توانند توسط ELISA اندازه گیری شوند. همانگونه که در PF گفته شد ، پروفایل اتوآنتی بادی در بیماران دچار PF (به عبارت دیگر anti-Dsg1 IgG) و توزیع بافتی اتوآنتی ژن (به عبارت دیگر، بیان درمخاط دهان که توسط بیان همزمان Dsg3 جبران می شود) مسئول توزیع ضایعات در این بیماری هستند . شکل اندمیک PF در نواحی روستایی جنوب مرکزی برزیل یافت می شود که در آنجا fs) fogo salvagem) نامیده می شود. همچنین در آمریکای لاتین و تونس دیده می شود فرم اندمیک PF همانند سایر فرم های این بیماری به واسطه اتوآنتی بادی IgG علیه Dsg1 ایجاد می شود. انواع FS با لیشمانیوز ، بیماری که با گزش پشه خاکی Lutzomyia longipalis ایجاد می شود ، هم پوشانی دارد .مطالعات اخیر نشان داده است که آنتی ژن بزاق دهان پشه خاکی (به خصوص پروتئین بزاقی LJMII) به واسطه اتوآنتی بادی های IgG دربیماران با FS شناخته شده است. ( مانند آنتی بادی منوکلونال مشتق از Dsg1 این بیماران).
گرچه PF با چندین بیماری اتوایمیون همراهی دارد، همراهی با تیموما و/ یا میاستنی گراویس به طور خاص قابل ذکر است. امروزه، بیش از ۳۰ مورد تیموما و/ یا میاستنی گراویس همراه با پمفیگوس ، معمولا PF گزارش شده اند. همچنین ممکن است بیماران دچار پمفیگوس ناشی از مصرف یک دارو شوند . پمفیگوس دارویی معمولاٌ مشابه PF است تا PV. داروهای حاوی گروه تیول در ساختار شیمیایی شان( برای مثال پنی سیلامین، کاپتوپریل ، انالاپریل ) بیشترین همراهی رابا پمفیگوس دارویی دارند. داروهای غیر تیولی مرتبط با پمفیگوس شامل پنی سیلین ها ، سفالوسپورین ها و پیروکسیکام هستند . احتمالا داروهای حاوی تیول و غیرتیولی به ترتیب از طریق مکانیسم های بیوشیمیایی و ایمونولوژیکی باعث القای پمفیگوس می شوند . لذا با قطع دارو، پیش آگهی موارد پمفیگوس ناشی ازداروهای حاوی تیول بهتر است . برخی موارد پمفیگوس دارویی طول کشنده هستند ونیازمند درمان با گلوکوکورتیکوئیدهای سیستمیک و/ یا عوامل ایمونوساپرسیو هستند. PF معمولاٌ شدت کمتری از PV دارد و پروگنوز بهتری دارد. بیماری موضعی گاهی می تواند با گلوکوکورتیکوئیدهای موضعی یا داخل ضایعه درمان شود، موارد فعال تر را می توان با گلوکوکورتیکوئیدهای سیستمیک کنترل کرد. همان طور که دربیماران دچار PV گفته شد، بیماران دچار بیماری شدید و مقاوم ممکن است نیاز به مداخلات تهاجمی تر داشته باشند.