خلاصه
پاتوفیزیولوژی و مسیر سندرم پست کووید ۲۰۱۹ نامشخص است. برای روشن شدن درگیری چند سیستمی، ما یک مطالعه کوهورت آینده نگر را شامل بیمارانی که با COVID-19 در بیمارستان بستری شده بودند انجام دادیم (شناسه ClinicalTrials.gov NCT04403607). طی این مطالعه بیومارکرهای سریال خون، الکتروکاردیوگرافی دیجیتال و نتایج گزارش شده توسط بیمار در بیمارستان و در ۲۸ تا ۶۰ روز پس از ترخیص زمانی که تصویربرداری چند سیستمی با استفاده از توموگرافی کامپیوتری قفسه سینه با آنژیوگرافی ریوی و کرونری و تصویربرداری رزونانس مغناطیسی قلبی-کلیوی عمل آمد. نتایج بالینی طولانیمدت با استفاده از پرونده الکترونیک سلامت ارزیابی شد. در مقایسه با گروه کنترل (n = ۲۹)، در ۲۸ تا ۶۰ روز پس از ترخیص، افراد مبتلا به COVID-19 (n = ۱۵۹؛ میانگین سنی، ۵۵ سال؛ ۴۳% زن) شواهد پایداری از درگیری قلبی-کلیه و فعال شدن مسیر هموستاز داشتند. احتمال ایجاد میوکاردیت در ۲۱ بیمار (۱۳%) “بسیار محتمل”، در ۶۵ بیمار (۴۱%) “محتمل”، در ۵۶ بیمار (۳۵%) “بعید” و در ۱۷ نفر (۱۱%) “عدم وجود” بود. در بررسی ۲۸ تا ۶۰ روز پس از ترخیص بیماران نتایج زیر حاصل شد:
کیفیت زندگی مرتبط با سلامت بدتر (امتیاز EQ-5D-5L 0.77 (0.23) در مقابل ۰.۸۷ (۰.۲۰))
اضطراب و افسردگی (PHQ-4 نمره کل ۳.۵۹ (۳.۷۱) در مقابل ۱.۲۸ (۲.۶۷))
ظرفیت ورزش هوازی منعکس شده توسط حداکثر استفاده از اکسیژن پیش بینی شده (۲۰.۰ (۷.۶) در مقابل ۲۹.۵ (۸.۰) ml/kg/min) (همه P <0.01) .
در طول پیگیری (میانگین، ۴۵۰ روز)، ۲۴ بیمار (۱۵%) و دو نفر از گروه کنترل (۷%) فوت کردند یا مجدداً در بیمارستان بستری شدند و ۱۰۸ (۶۸%) بیمار و هفت (۲۶%) نفر از گروه کنترل مراقبت های ثانویه سرپایی دریافت کردند (P = 0.۰۱۷). مسیر بیماری بیماران پس از بستری شدن در بیمارستان با COVID-19 شامل ناهنجاری های چند سیستمی و اختلالاتی است که می تواند منجر به افزایش قابل توجه تقاضا برای خدمات مراقبت های بهداشتی در آینده شود.
هسته مطالعه
خود گزارش دهی و مطالعات جمعیتی در مورد مسیر بیماری پست کووید-۱۹ نشان داده است که علائم باقیمانده، مانند خستگی، تنگی نفس و عدم تحمل ورزش، شایع هستند و به طور بالقوه منجر به افزایش تقاضا برای خدمات بهداشتی و درمانی در آغاز همهگیری کووید-۱۹ شد. مطالعات بالینی فاقد ارزیابی آیندهنگر از پاتوژنز بیماری و/یا وضعیت سلامتی بودند و بیماران را بهطور انتخابی فراخوانی میکردند و سوگیری انتخاب را معرفی میکردند. مطالعات آیندهنگر کمی گزارش شدهاند و تصویربرداری چند سیستمی با نتایج بالینی و کنترلهای مجدد اخیر وجود ندارد. بیماری از قبل موجود، انتساب استنباطهای علّی را در COVID-19 پیچیده میکند که باعث میشود پاتوفیزیولوژی و اهمیت بالینی سندرمهای پس از COVID-19 نامشخص باقی بماند.
پاتوژنز عامل التهاب چند عضوی در COVID-19 ممکن است شامل تهاجم مستقیم ویروس از طریق اتصال آنزیم مبدل آنژیوتانسین ۲ (ACE2) ، التهاب قلبی-کلیوی،اختلال عملکرد اندوتلیال، آنژیوپاتی میکروواسکولار ترومبوتیک، کاردیومیوپاتی استرسی و دارو باشد. این مکانیسمهای متمایز، زیرگروههایی را با درگیری چند عضوی در COVID-19 تعریف میکنند. میوکاردیت ممکن است باعث عوارض و مرگ و میر طولانی مدت در این بیماران شود. مطالعات قبلی با استفاده از تصویربرداری رزونانس مغناطیسی قلبی عروقی (MRI) در COVID-19، ویژگی های تصویربرداری التهاب میوکارد را در ۲۷ تا ۶۰٪ از بیماران گزارش کرده است. این مطالعات قابل اعتماد نبودند زیرا شامل انتخاب مورد بر اساس افزایش تروپونین و فراخوان گذشته نگر بودند. فقدان تصویربرداری از شریان کرونر نیز محدودیتی برای نسبت دادن علت آسیب میوکارد است که مستعد سوگیری تشخیصی می شود.
بر اساس تروپیسم قلبی عروقی سندرم حاد تنفسی کروناویروس ۲ (SARS-CoV-2)16، ابتدا فرض کردیم که مسیر بیماری سندرمهای پس از کووید-۱۹ شامل فعال شدن مسیر هموستاتیک و التهاب سیستمیک در طول دوره نقاهت است. دوم، اینکه درگیری قلبی-کلیوی با بیماری قلبی عروقی از قبل موجود مرتبط است. و سوم اینکه میوکاردیت پس از COVID-19 با اختلالات مداوم در وضعیت سلامتی، از جمله بهزیستی جسمی و روانی و نتایج بالینی مرتبط است. ما مکانیسمهای بیماری را با استفاده از تصویربرداری چند سیستمی، نشانگرهای زیستی و تغییرات آنها در کوتاهمدت (کمتر از ۳ ماه) و میان مدت (۱۲ تا ۱۸ ماه) بررسی کردیم. وضعیت سلامت و عملکرد جسمی و روانی به صورت سریالی با استفاده از عوارض گزارششده معتبر توسط بیمار ثبت شد و نتایج بالینی و استفاده از مراقبتهای بهداشتی به واسطه پرونده الکترونیک سلامت ارزیابی شد.
نتایج
در مجموع، ۱۳۰۶ بیمار بین ۲۲ می ۲۰۲۰ تا ۱۶ مارس ۲۰۲۱ غربالگری شدند و ۲۶۷ بیمار رضایت آگاهانه کتبی ارائه کردند. نمودار جریان در شکل ۱ نشان داده شده است، و نمونه موارد بالینی در شکل های داده های توسعه یافته ارائه شده است.

این روشها شامل غربالگری بیماران بستری در بیمارستان ۱۹ بود که با یک نتیجه مثبت PCR برای SARS-CoV-2 در سواب نازوفارنکس تعریف شده بود و سپس رضایت آگاهانه کتبی دریافت شد. جمعیت مورد تجزیه و تحلیل با یک نتیجه PCR مثبت تعریف می شود. تحقیقات سریال در بیمارستان یا اوایل پس از ترخیص (ویزیت ۱) آغاز شد و سپس در ارتباط با تصویربرداری چند عضوی در ۲۸ تا ۶۰ روز پس از ترخیص (ویزیت ۲) تکرار شد. پیگیری بالینی به طور متوسط ۸۸ ± ۴۵۰ روز ادامه یافت. (محدوده، ۲۹۰-۶۲۷ روز) پس از ترخیص.
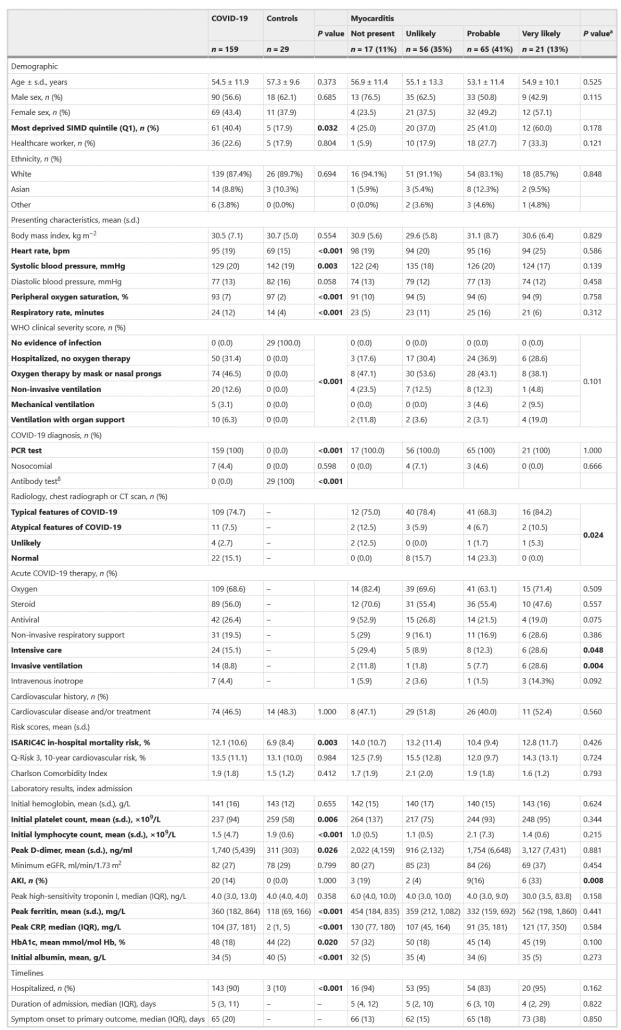
در مجموع، ۱۵۹ بیمار در ۲۸ تا ۶۰ روز پس از آخرین روز مراقبت بیمارستانی مورد بررسی قرار گرفتند. میانگین سنی آنها ۵۵ سال بود، ۱۳۹ نفر(۸۷%) سفیدپوست، ۱۴ نفر (۹%) آسیایی، چهار نفر (۳%) عرب، دو نفر (۱%) سیاه پوست، ۶۹ نفر (۴۳%) زن، ۷۴ نفر (۴۶%) سابقه بیماری قلبی عروقی یا درمان داشتند، ۶۱ نفر (۴۰ درصد) در بالاترین پنجک محرومیت اجتماعی و ۳۶ نفر (۲۳ درصد) کارکنان مراقبت های بهداشتی بودند (جدول ۱ و جداول تکمیلی ۱ و ۲). نمرات شدت بیماری بالینی در جدول ۱ توضیح داده شده است. ۲۲ بیمار (۱۵%) در طول بستری شدن، رادیولوژی قفسه سینه نرمال داشتند. دو نفر (۱.۲%) قبل از بستری شدن در بیمارستان یک دوز واحد از واکسن SARS-CoV-2 دریافت کرده بودند (جدول تکمیلی ۳). در رابطه با درمان کووید-۱۹، ۱۰۹ نفر (۶۹%) اکسیژن، 89 نفر (۵۶%) استروئید، ۴۲ نفر (۲۶%) درمان دارویی ضد ویروسی، ۳۱ نفر (۲۰%) حمایت تنفسی غیرتهاجمی و ۱۴ نفر تهویه تهاجمی (۹%) دریافت کردند.
(جدول ۱ و جداول تکمیلی ۱ و ۲). نمرات شدت بیماری بالینی در جدول ۱ توضیح داده شده است. ۲۲ بیمار (۱۵%) در طول بستری شدن، رادیولوژی قفسه سینه نرمال داشتند. دو نفر (۱.۲%) قبل از بستری شدن در بیمارستان یک دوز واحد از واکسن SARS-CoV-2 دریافت کرده بودند (جدول تکمیلی ۳). در رابطه با درمان کووید-۱۹، ۱۰۹ نفر (۶۹%) اکسیژن، 89 نفر (۵۶%) استروئید، ۴۲ نفر (۲۶%) درمان دارویی ضد ویروسی، ۳۱ نفر (۲۰%) حمایت تنفسی غیرتهاجمی و ۱۴ نفر تهویه تهاجمی (۹%) دریافت کردند.
مقایسه با گروه کنترل
۲۹ بیمار کنترل با سن، جنس، قومیت و عوامل خطر قلبی عروقی مشابه، طی یک ویزیت منفرد بین ۱۳ آوریل و ۲ ژوئیه ۲۰۲۱ تحت روش های تحقیقاتی مشابه قرار گرفتند. ویژگی های آنها در جدول ۱ توضیح داده شده است. بیماران مبتلا به کووید-۱۹ در مقایسه با گروه شاهد در هنگام ثبتنام، تفاوتهای چند سیستمی در بیماری حاد داشتند.
کارمندان خدمات درمانی
۳۶ نفر (۲۳%) کارکنان مراقبت های بهداشتی بودند. در مقایسه با کارکنان غیربهداشتی، کارکنان مراقبتهای بهداشتی جوانتر بودند (میانگین سنی (s.d.)، ۵۱ (۹) سال در مقابل ۵۵ (۱۳) سال؛ P = ۰.۰۱۳) و اغلب زن (۲۶ نفر(۷۲.۲%) در مقابل ۴۳ (۳۵.۰%) ؛ P < ۰.۰۰۱) و از قومیت غیرسفید (۸ نفر(۲۲.۲%) در مقابل ۱۲ (۹.۸%)؛ P = ۰.۰۴۳) بوده اند. آنها درصد خطر قلبی عروقی ۱۰ ساله کمتری داشتند (% ۸.۱ (۷.۹) در مقابل ۱۴.۹ (۱۱.۴)؛ P = ۰.۰۰۴) و شاخص Charlson Comorbidity Index کمتر (۱.۴ (۱.۶) در مقابل ۲.۰ (۱.۹)؛ P ۰.۳ = 0) داشتند.
بررسی های چند سیستمی: مقایسه با کنترل ها
در بیماران بستری شده با COVID-19، در مقایسه با گروه شاهد، تصویربرداری قلب، ریه و کلیه، الکتروکاردیوگرافی و بیومارکرهای چند سیستمی چندین ناهنجاری پایدار را نشان داد (جدول ۲).
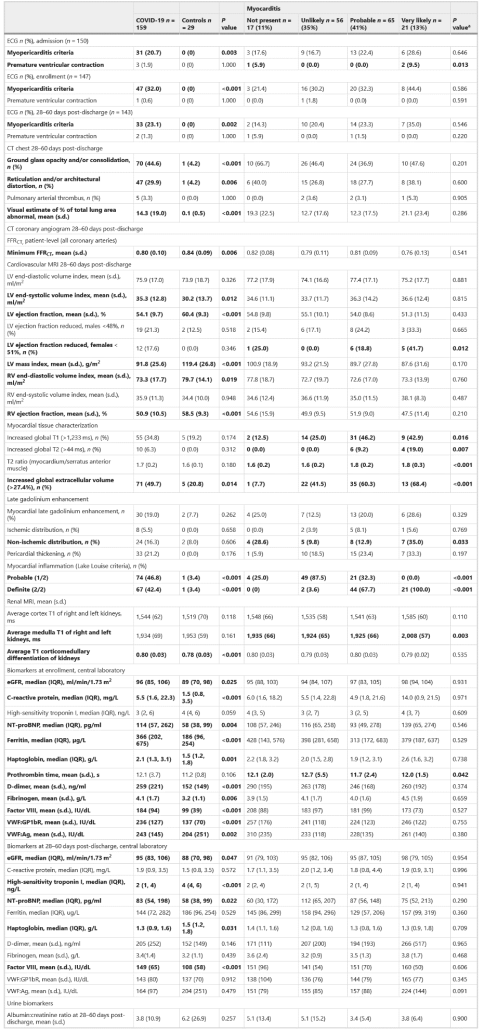
در ۶۰-۲۸ روز پس از ترخیص (ویزیت ۲)، طی توموگرافی کامپیوتری (CT) وجود ناهنجاری قفسه سینه شایع بود. در گروه پست کووید-۱۹، حداقل توموگرافی کامپیوتری فراکشنال (FFRCT) کمتر از گروه کنترل بود که با بیماری عروق کرونر محدودکننده جریان، بیشتر سازگار بود. MRI تفاوت های خفیفی را در عملکرد بطن نشان داد و از هر پنج بیمار یک نفر شواهدی از فیبروز میوکارد داشت که با افزایش دیررس گادولینیوم آشکار شد. یافتههای MRI کلیه بین گروههای کووید-۱۹ و کنترل مشابه بود.
غلظتهای در گردش CRP، فریتین، D-دایمرها، فیبرینوژن، فاکتور VIII و فاکتور فون ویلبراند در گروه پست کووید-۱۹ در زمان ثبتنام در مقایسه با گروه کنترل بالاتر بود، که با فعالسازی مسیر هموستاتیک سازگار بود. در ۶۰-۲۸ روز پس از ترخیص، غلظت فاکتور VIII بالا باقی ماند. غلظتهای گردشی پپتید ناتریورتیک پرو B نوع N-ترمینال (NT-proBNP) در گروه COVID-19 در هنگام ثبتنام و ۲۸ تا ۶۰ روز پس از ترخیص بیشتر بود.
نتیجه اولیه
احتمال میوکاردیت با اجماع (روشها) در ۲۱ بیمار (۱۳%) بهعنوان “بسیار محتمل”، در ۶۵ بیمار (۴۱%) “محتمل”، در ۵۶ بیمار (۳۵٪) “بعید” و در در ۱۷ بیمار (۱۱%) “عدم وجود” تعیین شد. احتمال تشخیص میوکاردیت با ویژگیهای رادیولوژیک معمول COVID-19 (P = ۰.۰۲۴)، بستری در مراقبتهای ویژه (P = ۰.۰۴۸) و تهویه تهاجمی (P = ۰.۰۰۴) مرتبط بود، اما هیچ ارتباطی با ویژگیهای دموگرافیک، سابقه قلبی عروقی و نتایج خون مراقبت استاندارد به دست آمده در طول بستری وجود نداشت. (جدول ۱).
با اختصاص یک مقیاس ترتیبی از مقادیر ۱ تا ۴ برای احتمال میوکاردیت، واریانس کل در همه رتبهبندیها ۰.۸۸۵ بود. واریانس بین رتبه بندی های قضاوت شده ۰.۷۲۵ بود. نسبت تغییرات بین بیمار به کل تغییرات ۰.۸۲ بود که با درجه بالایی از قابلیت اطمینان در رتبهبندیهای متوسط مطابقت دارد. هر ارزیاب n = ۳۰ مورد را به شیوهای کورکورانه مجدداً ارزیابی کرد تا تنوع درون مشاهدهگر را ارزیابی کند. میانگین وزنی آمار کاپا برای طبقه بندی احتمال میوکاردیت به چهار سطح ۰.۶۹ و برای طبقه بندی باینری (محتمل / بسیار محتمل در مقابل وجود ندارد / بعید) ۰.۷۹ بود.
فنوتیپ چند سیستمی و میوکاردیت تشخیص داده شده
الکتروکاردیولوژی
انقباضات زودرس بطنی مرتبط با احتمال میوکاردیت (جدول ۲).
سی تی قفسه سینه، آنژیوگرافی عروق کرونر و ریه
میوکاردیت با توزیع آترواسکلروز عروق کرونر (نمره گزارش بیماری عروق کرونر و سیستم داده (CADS-RADS)؛ P = ۰.۰۱۳) (جدول تکمیلی ۲) همراه بود، اما هیچ یافته CT دیگری در ۲۸ تا ۶۰ روز وجود نداشت.
MRI قلب و عروق
میوکاردیت با کاهش EF بطن چپ در زنان مرتبط بود (جدول ۲). الگوهای متمایز آسیب شناسی میوکارد با تصویربرداری با افزایش تاخیری گادولینیوم نشان داده شده در داده های توسعه یافته شکل ۷ نشان داده شده است.
ام آر آی کلیه
میوکاردیت با آسیب حاد کلیه (AKI) در طول پذیرش اولیه همراه بود. در روزهای ۶۰-۲۸، میانگین T1 (ms) رنال مدولا T1 (ms)، که نوعی تصویربرداری جهت بررسی التهاب در کلیه چپ و راست است، با میوکاردیت محق شده همراه بود (۰۰۳/۰= P).
اتیولوژی میوکاردیت
علت التهاب میوکارد نیز مورد قضاوت قرار گرفت. میوکاردیت SARS-COV-2 در ۱۴ بیمار (۶۶.۷٪) محتمل یا در هفت (۳۳.۳٪٪) بیمار مبتلا به میوکاردیت (P < ۰.۰۰۱) بسیار محتمل تشخیص داده شد (جدول تکمیلی ۴). اختلال در جریان خون میوکارد به عنوان یک عامل استرس زا در التهاب در شش (۹.۳٪) بیمار مبتلا به میوکاردیت محتمل یا بسیار محتمل تعیین شد (P <0.001).
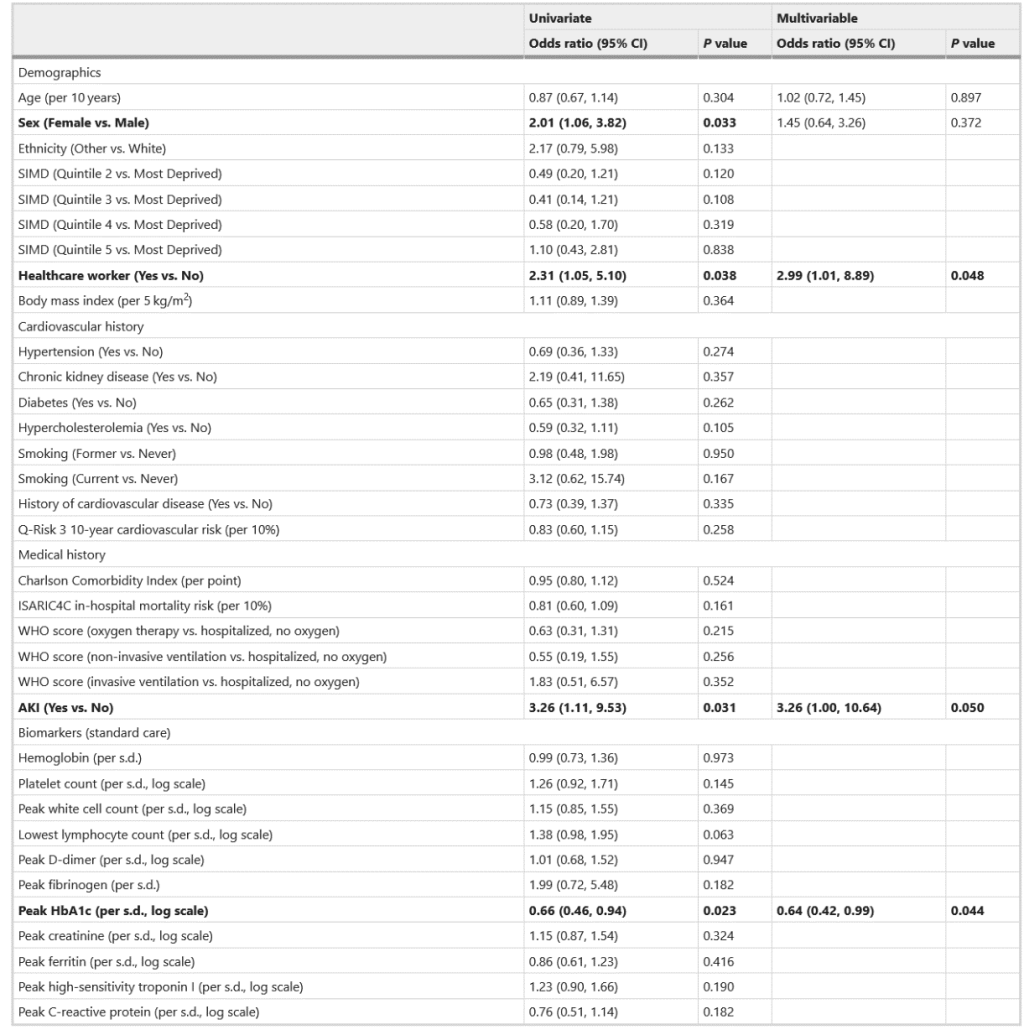
ارتباطات چند متغیره میوکاردیت
ارتباط تک متغیره و چند متغیره بین معیارهای جمعیت شناختی و بالینی انتخاب شده در ثبت نام (بازدید ۱) و قضاوت در مورد میوکاردیت که محتمل یا بسیار محتمل است با مدل های رگرسیون لجستیک ارزیابی شد (جدول ۳). وضعیت کارکنان بخش بهداشت و درمان به شکل زیر بود: (نسبت شانس، فاصله اطمینان ۹۵%: ۲.۹۹ (۱.۰۱، ۸.۸۹)، P = ۰.۰۴۸)،
AKI (3.26 (1.00, 10.64); P = ۰.۰۵۰)
و افزایش HbA1c (در مقیاس استاندارد) (۰.۶۴ (۰.۴۲، ۰.۹۹؛ P = ۰.۰۴۴) فاکتورهای چند متغیره در میوکاردیت بودند.
ارتباط معکوس بین (HbA1c (mmol/mol و احتمال میوکاردیت در داده های توسعه یافته شکل ۸ نشان داده شده است. تطابق بین ارزیاب ها برای تشخیص میوکاردیت در جدول تکمیلی ۵ نشان داده شده است. داده ها سطح بالایی از تطابق را نشان می دهد. ارتباط معیارهای تست بالینی و تشخیصی برای میوکاردیت و تشخیص محق شده در نمودار رادار (داده های توسعه یافته شکل ۹) و در جدول تکمیلی ۶ نشان داده شده است.
وضعیت سلامت
در مقایسه با گروه شاهد، در هنگام ثبت نام و ۶۰-۲۸ روز پس از ترخیص، بیماران مبتلا به کووید-۱۹ کیفیت زندگی مرتبط با سلامتی پایینتری داشتند، ادراک بیماری بهبود یافته، سطوح بالاتری از اضطراب و افسردگی، سطوح پایینتر فعالیت بدنی و حداکثر مصرف اکسیژن پیش بینی شده (ml/kg/min) پایین تری یافت شد. (جدول ۴)
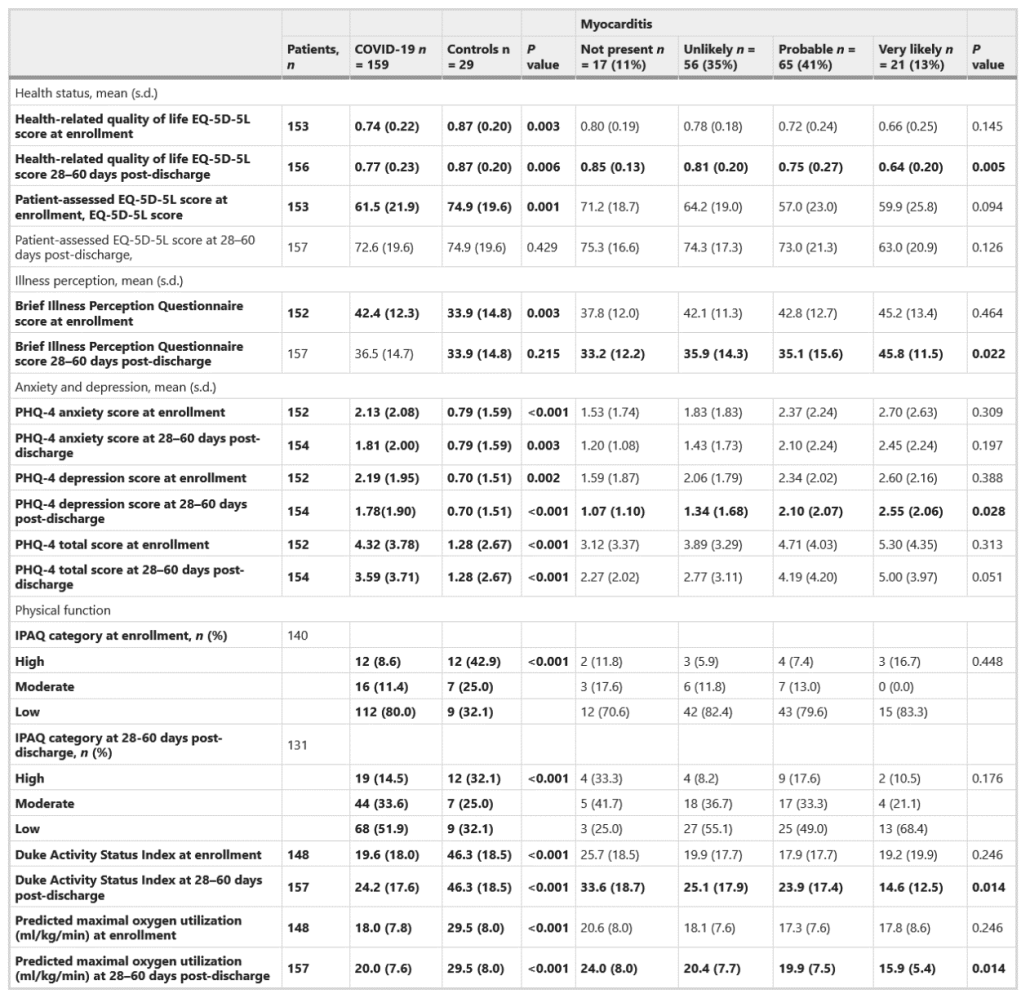
میوکاردیت مرتبط با معیارهای پیامد گزارش شده توسط بیمار در ۲۸ تا ۶۰ روز پس از ترخیص شامل موارد زیر از جمله: کیفیت زندگی مرتبط با سلامت پایین تر (۰۰۵/۰= P)، افزایش ادراک بیماری (۰۲۲/۰= P)، افزایش نمره افسردگی (P =P ۰.۰۲۸)، فعالیت بدنی کمتر (P = ۰.۰۱۴) و حداکثر مصرف اکسیژن پیش بینی شده کمتر (ml/kg/min) (P = ۰.۰۱۴) بود.
عوارض جانبی جدی
پیگیری تا ۱۳ دسامبر ۲۰۲۱ برای همه شرکت کنندگان ادامه یافت. میانگین (s.d.، محدوده) مدت زمان پیگیری پس از ترخیص از بیمارستان ۴۵۰ (۸۸) روز (محدوده، ۲۹۰-۶۲۷ روز) بود. عوارض جانبی جدی (SAE) که در طول پذیرش ایندکس رخ می دهد و علل مرگ و بستری مجدد پس از ترخیص به طور قطعی در جداول تکمیلی ۷-۹ آمده است.
چهار بیمار در طول دوره مطالعه فوت کردند، از جمله دو مرگ قبل از ویزیت ۲ و دو مرگ پس از ویزیت ۲.
24 بیمار (۱۵.۱٪) پس از COVID-19 و دو نفر (۴.۷٪) از بیماران کنترل فوت کردند یا دوباره در بیمارستان بستری شدند (P = ۰.۳۵۶ ). یکصد و هشت بیمار (۶۷.۹%) COVID-19 و هفت نفر (25.9%) از گروه کنترل یک دوره مراقبت ثانویه سرپایی داشتند (۰۱۷/۰ =P)، و بیماران بیشتری که COVID-19 داشتند برای علائم مطابق با معیارهای NICE188 برای کووید-۱۹ طولانی (۵۸ نفر (۳۶.۵%) در مقابل 1 نفر (۳.۷%)؛ P = ۰.۰۱۷). ارجاع داده شدند. احتمال تشخیص میوکاردیت با تشخیص فیبروز ریوی مرتبط بود (۰۰۱/۰< P). داروهای تجویز شده در طول پیگیری در جدول تکمیلی ۱۰ توضیح داده شده است.
بحث
ما آسیب شناسی چند سیستمی را همراه با وضعیت سلامت گزارش شده توسط بیمار، ظرفیت ورزش هوازی و نتایج بالینی در طول یک دوره ۱۴ ماهه پس از بستری شدن در بیمارستان برای COVID-19 بررسی کردیم. از هر هفت بیمار یک نفر فوت کرد یا دوباره در بیمارستان بستری شد و دو سوم آنها یک دوره مراقبت ثانویه سرپایی داشتند.
نتایج ما شکاف علمی موجود بین سندرمهای پس از کووید-۱۹ و شواهد عینی بیماری پر میکند. ما شواهدی از آسیب مداوم قلبی-کلیوی چند سیستمی، از جمله افزایش غلظت گردش خون NT-proBNP، نشانگر زیستی نشاندهنده اختلال در عملکرد قلب و پیش آگهی آن، و فاکتور VIII که منعکس کننده فعال شدن مسیر هموستاز است پیدا کردیم. این ناهنجاری ها تا حدودی اختلالات طولانی مدت در کیفیت زندگی مرتبط با سلامت، عملکرد فیزیکی و رفاه روانی گزارش شده توسط بیمار را توجیه می کند. در مجموع، یافتههای ما مسیرهای آسیب چند سیستمی را به عنوان واسطههای سندرم پس از کووید-۱۹ نشان میدهد.
بروز میوکاردیت که ۲۸ تا ۶۰ روز پس از کووید-۱۹ ادامه داشت تقریباً از هر هشت بیمار (۱۳٪) یک نفر را تحت تأثیر قرار داد که کمتر از گزارش های مطالعات قبلی (۲۷-۶۰٪) است. علت میوکاردیت عمدتاً عفونت SARS-CoV-2 و با شیوع کمتری ایسکمی میوکارد ناشی از بیماری عروق کرونر بود (جدول تکمیلی ۴). اهمیت بالینی میوکاردیت که کووید-۱۹ را پیچیده می کند با ارتباط با فیبروز ریوی که در طول پیگیری تشخیص داده می شود برجسته می شود.
بافت اسکار میوکارد عملکرد پمپ قلب را کاهش می دهد، و در جمعیت عمومی، بافت اسکار میوکارد پیش آگهی نامطلوبی ایجاد می کند. در گروه پست COVID-19، جدا از گروه شاهد، اسکار میوکارد یک یافته کاملا شایع بود که از هر پنج بیمار یک نفر را تحت تاثیر قرار می دهد. . ویژگی های رادیولوژیکی الگوهای اسکار میوکارد متمایز بوده و نشان دهنده حاد بودن آن است. در گروه ما، توزیع فیبروز علل مشخصی از آسیب حاد میوکارد، از جمله میوکاردیت، ترومبوز میکروواسکولار و انفارکتوس میوکارد را نشان داد. ویژگی های تصویربرداری همچنین فیبروز از قبل موجود را با یک الگوی غیر ایسکمیک شناسایی کردند (داده های توسعه یافته شکل ۷). پیامدهای پیش آگهی این یافته ها باید از طریق مطالعات پیگیری طولی روشن شود.
هموگلوبین A1c (٪) با میوکاردیت محق شده همراه بود، اما در جهت مخالف آنچه ممکن است مورد انتظار باشد که بنابراین نیاز به اعتبارسنجی در گروه های دیگر دارد. این مکانیسم ممکن است شامل التهاب سیستمیک باشد که منجر به کم خونی همولیتیک میکروآنژیوپاتیک و کاهش بقای گلبول های قرمز می شود. هموگلوبین A1c (%) به طور مثبت با تعداد داروهای مصرفی ضد دیابت مرتبط بود (داده های توسعه یافته شکل ۱۰)، که دلالت بر درمان پزشکی فشرده تر دارد. همچنین علیت معکوس نیز ممکن است مرتبط باشد. به عنوان مثال، اگر افراد «مناسب» با HbA1c پایین در نهایت در بیمارستان بستری شوند، در آن صورت بیماری کووید-۱۹ ضعیف تری را تجربه میکنند، در حالی که افراد با عوامل خطر قلبی عروقی و عوارض قلبی عروقی از قبل موجود (و HbA1c بالاتر) تحمل (یا ظرفیت بافر) کمتری برای بیماری دارند و با بیماری نسبتاً خفیف COVID-19 در بیمارستان بستری می شوند.
AKI مرگ و میر در COVID-19 را نشان می دهد (مراجعه ۱۱،۲۵). میوکاردیت تایید شده با AKI در طول بستری و شواهد تصویربرداری التهاب در مدولا کلیه ۲۸ تا ۶۰ روز پس از ترخیص همراه بود. این ارتباط ممکن است با مسیرهای آسیب سیستمیک – یعنی التهاب، فعال شدن هموستاز، اختلال عملکرد میکروواسکولار و عفونت مداوم COVID-19 – یا ترکیبی از این آسیبشناسی توضیح داده شود. با در نظر گرفتن شواهد بالینی، نتایج از یک رویکرد مدیریت طبقه بندی شده برای بیمارانی که علایمم پست کووید-۱۹ را در اوایل دوران نقاهت داشتند حمایت می کند. از نشانگرهای زیستی، مانند NT-proBNP، می تواند توسط پزشکان برای طبقه بندی ریسک بیماران برای مدیریت درمانی آنها و توانبخشی بیشتر در طول دوره نقاهت استفاده شود.
تقریباً یک چهارم بیماران مبتلا به کووید-۱۹ کارکنان مراقبت های بهداشتی بودند، و این وضعیت شغلی یک رابطه چند متغیره از احتمال ایجاد میوکاردیت با نسبت شانس سه برابر بالاتر بود. کارکنان مراقبت های بهداشتی جوان تر، اغلب زن و از قومیت غیر سفیدپوست بودند و عوامل خطر قلبی عروقی و شرایط همراه کمتری داشتند. علیت معکوس ممکن است از این نظر مرتبط باشد که افراد با زمینه سلامت نسبتاً خوب ظرفیت بیشتری برای مقاومت در برابر COVID-19 دارند، و در افرادی که در نهایت به مراقبت های بیمارستانی نیاز دارند، این بیماری شدیدتر است، از جمله همراهی عوارضی مانند میوکاردیت. عامل دوم می تواند قرار گرفتن در معرض SARS-CoV-2 را افزایش دهد، زیرا برخی از کارکنان مراقبت های بهداشتی به طور مکرر در معرض منابع عفونت در محل کار خود قرار می گیرند که به طور بالقوه منجر به بار ویروسی بیشتر در قرار گرفتن در معرض آنها می شود که البته این فرضیه مستلزم بررسی بیشتر است.
سندرم پس از COVID-19 (“کووید طولانی”) عمدتاً زنان را تحت تأثیر قرار می دهد. نسبت زنان با احتمال ابتلا به میوکاردیت افزایش مییابد، و جنس مونث یک همبسته غیرقابل تغییر میوکاردیت محق شده بود، که به نوبه خود با آسایش ذهنی و جسمی پایینتری همراه بود. میوکاردیت محق شده با اختلال عملکرد سیستولیک بطن چپ در زنان همراه بود. یافتههای ما یک مبنای پاتوفیزیولوژیک برای محدودیت فیزیکی در برخی از بیماران زن مبتلا به پست COVID-19 ارائه میکند.
افزایش تروپونین یک معیار تشخیصی برای میوکاردیت است. با این حال، غلظت تروپونین در گردش ممکن است به دلیل هیپوکسی، افت فشار خون، ایسکمی و نارسایی کلیوی و همچنین آسیب موضعی میوکارد افزایش یابد. افزایش تروپونین فاقد ویژگی تشخیصی است و این منجر به عدم قطعیت در عمل بالینی می شود. ارزیابی بالینی بیماران مبتلا به کووید-۱۹ و علائم قفسه سینه باید شامل شرح حال دقیق، معاینه (ضربان قلب، ریتم، فشار خون و سمع) و الکتروکاردیوگرام ۱۲ لید (ECG) باشد. اگر یافتههای قلبی وجود داشته باشد، بیومارکرهای خون – به عنوان مثال، سنجش تروپونین با حساسیت بالا – باید اندازهگیری شوند، و اگر غیرطبیعی باشد، تصویربرداری – برای مثال اکوکاردیوگرافی – باید صورت گیرد . هنگامی که یافتههای قلبی متمایز مثبت میشوند – برای مثال، درد قفسه سینه پریکارد، ST Elevation به شکل زین در ECG و آریتمیهای بطنی – از احتمال میوکاردیت حمایت میکند. . ارجاع برای اقدامات تشخیصی باید از نظر خطر انتقال عفونت به کارکنان با احتیاط انجام شود. مطالعه ما باید بهروزرسانیهای دستورالعمل بالینی را برای مراقبت یکپارچه از بیماران مبتلا به علائم پایدار پست COVID-19 ارائه کند.
اگرچه هیچ درمان مبتنی بر شواهد برای سندرم های پست کووید-۱۹ وجود ندارد، درمان های حاد مانند دگزامتازون باید احتمال بروز میوکاردیت را کاهش دهند. شواهد فعال شدن مسیر هموستاز یک ارتباط پاتوفیزیولوژیکی برای اثرات مفید درمان ضد ترومبوتیک در جمعیت های بستری در بیمارستان فراهم می کند. کارآزمایی RECOVERY در حال بررسی اثرات درمانهای تعدیلکننده ایمنی، مانند باریسیتینیب، و امپاگلیفلوزین، مهارکننده همرساننده سدیم-گلوکز-۲ است که اثرات مفیدی در بیماران مبتلا به دیابت نوع ۲ در معرض خطر قلبی عروقی بالا دارد. دادههای دفتر آمار ملی بریتانیا نشان میدهد افرادی که دو دوز واکسن مصرف کردهاند، ۴۱.۱ درصد کمتر احتمال دارد که علائم طولانیمدت کووید را گزارش کنند. تأثیر واکسیناسیون بر مسیر بیماری در بلندمدت جای بررسی بیشتری دارد.
طبق دانش ما، پروتکل چند سیستمی شامل تصویربرداری همزمان قلب، ریه و کلیه قبلاً اجرا نشده است. آنژیوگرافی عروق کرونر با FFRCT سطح بالایی از اطمینان را برای شناسایی بیماری عروق کرونر محدود کننده جریان ارائه می دهد. این امر محتمل است زیرا بیماری عروق کرونر از قبل موجود که منجر به ایسکمی می شود، یک علت مخدوش کننده در التهاب میوکارد است. مطالعه ما برای به حداقل رساندن سوگیری انتخاب طراحی شده است. استفاده از سوابق الکترونیکی سلامت در سطح بیمارستان یک رویکرد غربالگری بی طرفانه و آینده نگر را تسهیل کرد. افزایش تروپونین معیار واجد شرایط بودن نبود و اختلال عملکرد کلیوی نیز معیار خروج نبود. طرح مطالعه ما از مطالعات قبلی که شامل جمعیتهای منتخب (COVID-HEART35 و COVIDsortium36)، انتخاب کیس گذشتهنگر ، یا حجم نمونه محدودکننده نتایج که قابل تعمیم بود، جدا است. یک مطالعه غربالگری قلبی روی ۷۸۹ ورزشکار حرفهای آمریکای شمالی که تست COVID-19 مثبت داشتند، ناهنجاریهای قلبی غیرمعمول (۳.۸٪) و میو پریکاردیت در ۰.۶٪ آنها را بدون عوارض قلبی شناسایی کرد. مطالعه ما سوگیری تشخیص را به حداقل رساند، که ممکن است بر مطالعات قبلی میوکاردیت تأثیر گذاشته باشد. تشخیص هر بیمار به طور مستقل توسط کمیته ای متشکل از متخصصان قلب مورد قضاوت قرار گرفت و تجزیه و تحلیل آماری توسط متخصصین آمار زیستی مستقل از تیم تحقیقاتی انجام شد. با توجه به اینکه مطالعه شامل یک رویکرد آزمایشگاهی مرکزی بود، تغییرات اندازهگیری به حداقل رسید. سوابق الکترونیکی سلامت برای ارزیابی های بعدی مورد استفاده قرار گرفت و هیچ داده ای گم نشد. برای به حداقل رساندن انتقال COVID-19 به کارکنان ما در طول مطالعه، تصویربرداری از ۲۸ روز پس از ترخیص برنامه ریزی شد. این رویکرد با مطالعه کنسرسیوم مشخصه بالینی ویروس کرونا حاد تنفسی و عفونت حاد بینالمللی (ISARIC4C) مطابقت دارد. از آنجایی که تصویربرداری در دوره حاد انجام نشد، برخی از آسیب شناسی ها ممکن است تا ۲۸ روز برطرف شوند. اکثر بیماران در گروه ما در طول ثبت نام واکسینه نشده بودند. تعریف AKI بر اساس نتایج آزمایش خون داخل بیمارستانی بود. بیوپسی اندومیوکارد انجام نشد. سوگیری انتخاب و قطعیت به حداقل رسید اما حذف نشد و بیمارانی که برای پیروی از روشهای مطالعه بسیار ضعیف تلقی میشدند ثبت نام نکردند.
نتیجه گیری
سیر بیماری COVID-19 شامل التهاب مداوم قلبی-کلیوی، درگیری ریه، فعال شدن مسیر هموستاتیک و اختلال در عملکرد فیزیکی و روانی است. از هر هفت بیمار، یک نفر فوت کرد یا دوباره در بیمارستان بستری شد، و از هر سه بیمار، دو نفر دورههای مراقبتهای ثانویه سرپایی بیشتری داشتند که به طور قابلتوجهی بیشتر از گروه کنترل بود. درمان پیشگیرانه برای سندرم های پست COVID-19 و مطالعات طولانی مدت از نظر پیش آگهی ضروری است.
مواد و روش ها
طرح
این مطالعه دارای طراحی آینده نگر، مشاهده ای، چند مرکزی و طولی برای ارزیابی دوره زمانی آسیب مولتی ارگان در بازماندگان COVID-19 در طول دوره نقاهت بود (ClinicalTrials.gov ID NCT04403607)
اطلاعات بالینی، از ECG دیجیتال ۱۲ لید، بیومارکرهای خون و ادرار و معیارهای نتیجه گزارش شده توسط بیمار در ثبت نام (ویزیت ۱) و دوباره در طول دوره نقاهت، ۲۸ تا ۶۰ روز پس از ترخیص (ویزیت ۲) به دست آمد. سی تی قفسه سینه شامل آنژیوگرافی ریه و کرونری و MRI قلب و کلیه در ویزیت دوم گرفته شد.
شاخص محرومیت چندگانه اسکاتلند (SIMD) یک مقیاس کوچک از محرومیت اجتماعی است که بر اساس هفت عامل (درآمد، اشتغال، تحصیل، بهداشت، دسترسی به خدمات، جرم و جنایت و مسکن) و در پنجک های عمومی طبقه بندی می شود. برای اندازه گیری محرومیت اجتماعی از SIMD استفاده شد.
تنظیمات
این مطالعه شامل سه بیمارستان در غرب اسکاتلند (جمعیت، ۲.۲ میلیون نفر) بود: بیمارستان دانشگاه ملکه الیزابت، بیمارستان سلطنتی گلاسکو و بیمارستان رویال الکساندرا در پیزلی.
شناسایی شرکت کننده
بیمارانی که برای COVID-19، با یا بدون بستری، مراقبت های بیمارستانی دریافت کردند و زنده ماندند، با استفاده از یک سیستم اطلاعات الکترونیکی مراقبت های بهداشتی (TrakCare، InterSystems) و گزارش های روزانه بیمارستانی که بیماران بستری را با نتایج آزمایشگاهی مثبت برای COVID را شناسایی می کردند، به صورت آینده نگر غربالگری شدند.
معیارهای واجد شرایط بودن
معیارهای ورود به مطالعه عبارت بودند از: (۱) سن ≥۱۸ . (۲) سابقه ویزیت برنامه ریزی نشده بیمارستان – برای مثال، بخش اورژانس یا بستری شدن در بیمارستان بیش از ۲۴ ساعت برای COVID-19 که توسط آزمایش آزمایشگاهی تأیید شده است (به عنوان مثال، واکنش زنجیره ای پلیمراز (PCR)). (3) توانایی پیروی از روش های مطالعه. و (۴) توانایی ارائه رضایت آگاهانه کتبی. نتایج تصویربرداری توسط رادیولوژیست های معتبر طبق دستورالعمل های ملی نوین گزارش شده است.
معیارهای خروج عبارت بودند از: (۱) منع انجام MRI (به عنوان مثال، کلاستروفوبیا شدید یا جسم خارجی فلزی) و (۲) عدم رضایت آگاهانه.
غربالگری
گزارش غربالگری آینده نگر تکمیل شد. دلایل عدم واجد شرایط بودن، از جمله نداشتن معیارهای ورود و/یا وجود معیارهای خروج، ثبت شد.
تشخیص COVID-19
تشخیص COVID-19 بر اساس شواهد آزمایشگاهی عفونت SARS-CoV-2 با استفاده از آزمایش PCR (Roche Cobas 6800 یا Seegene SARS-CoV-2 PCR) روی یک نمونه زیستی بود. تستهای آزمایشگاهی شامل Roche Cobas 6800 یا Seegene SARS-CoV-2 PCR بودند.
گروه کنترل
گروطرح مطالعه شامل یک گروه کنترل متشکل از حداقل ۲۰ نفر بود که با استفاده از همان اسکنرها و روشهای آزمایشگاهی اصلی، مراحل تحقیقاتی مشابهی را انجام میدادند. گروه کنترل به گونهای طراحی شد که از نزدیک ویژگیهای جمعیت مورد مطالعه، از جمله قسمتهای اخیر مراقبتهای ثانویه را در صورت امکان نشان دهد.ه کنترل
در آگوست ۲۰۲۰، یک تجزیه و تحلیل موقت از ویژگی های شرکت کنندگان COVID-19 برای تعریف معیارهای ثبت نام برای گروه کنترل انجام شد.
n = ۴۱ بیمار
میانگین (s.d.) سن: ۵۵ (۱۱) سال
جنسیت: ۵۳% مرد، ۴۷% زن
عوامل خطر قلبی عروقی شایع بودند.
معیارهای واجد شرایط بودن – شمول
1. محدوده سنی ۴۰ تا ۸۰ سال
2. حداقل یک عامل خطر قلبی عروقی بر اساس معیارهای ASSIGN: http://www.assign-score.com/estimate-the-risk/risk-factors/#more-info
سن > 65 سال
پنجک های SIMD 1 یا ۲
سابقه خانوادگی بیماری عروق کرونر قلب یا سکته مغزی
دیابت
روماتیسم مفصلی
سیگاری
فشار خون سیستولیک (معیارهای ASSIGN) یا سابقه فشار خون درمان شده
هیپرلیپیدمی (معیارهای ASSIGN) یا سابقه هیپرلیپیدمی درمان شده
شاخص توده بدنی ≥۳۰ kg m-2
معیارهای واجد شرایط بودن – حذف
سابقه قبلی: انفارکتوس میوکارد- میوکاردیت- نارسایی قلبی- بیماری ساختاری قلب- سرولوژی مثبت برای COVID-19- تاریخچه COVID-19 -رویکرد غربالگری برای کنترل
کارکنان تحقیقات پزشکی سوابق سلامت الکترونیکی بیماران تحت مراقبت یا تماس های شخصی را با دوره های شناخته شده مراقبت در مراقبت های اولیه یا ثانویه بررسی کردند. رویکرد غربالگری بیمارانی را که سابقه قبلی عفونت کووید-۱۹ داشتند حذف کرد. قبل از بازدید تحقیقاتی، یک آزمایش خون برای سرولوژی COVID-19 (Abbott Architect CMIA SARS-CoV-2 IgG assay) برای تأیید عدم وجود عفونت قبلی با COVID-19 استفاده شد. برای ادامه بازدید پژوهشی نتیجه منفی لازم بود. همه افراد کنترل تست سرولوژیک برای COVID-19 منفی داشتند.
تشخیص آسیب میوکارد
تشخیص آسیب میوکارد مطابق با چهارمین تعریف جهانی انفارکتوس میوکارد است. تروپونین I در بیماران بستری در بیمارستان با استفاده از روش Abbott Architect STAT TnI اندازه گیری شد (محدودیت مرجع بالای صدک ۹۹ بالای جنسیت: زن: > 16 ng L-1، مرد: >34 ng L-1). نمونه خون سریالی برای تشخیص تغییرات زمانی در غلظت تروپونین در گردش خون برای طبقه بندی آسیب حاد در مقابل آسیب مزمن میوکارد انجام شد.
تشخیص AKI
هر مرحله از AKI (1-3) در طول بستری COVID-19 با استفاده از طبقهبندی با معیارهای (KDIGO) تعریف شد.
برنامه تحقیقاتی
پروتکل شامل دو ویزیت بود. اولین ویزیت شامل رضایت آگاهانه و ارزیابی در طول بستری اولیه یا در اسرع وقت پس از ترخیص بود. ویزیت دوم ۲۸ تا ۶۰ روز پس از ترخیص انجام شد. این پنجره طوری قرار داده شده است که فاز نقاهت را منعکس کند و محدوده کافی برای برنامه ریزی به بیماران را بدهد.
نشانگرهای زیستی
برای بررسی مکانیسمهای آسیب قلبی عروقی ناشی از عفونت SARS-CoV-2، نمونههای خون و ادرار در هنگام ثبتنام (ویزیت ۱) و ۲۸ تا ۶۰ روز پس از ترخیص (بازدید ۲) جمعآوری شد.
نمونههای خون جمعآوریشده در سیترات سدیم ۰.۱۰۹ مولار (برای سنجش هموستاز) یا EDTA (برای سایر نشانگرهای زیستی) طبق یک کتابچه راهنمای حمل نمونه، که در همه سایتها ارائه شده بود، نگهداری شدند. نمونههای خون بهصورت موضعی سانتریفیوژ شدند و پلاسما در ۸۰- درجه سانتیگراد در عرض ۲ ساعت پس از نمونهبرداری جدا و منجمد شد. نمونههای باقیمانده برای ذخیرهسازی در پایان مطالعه به مخزن زیستی NHS Glasgow منتقل شدند.
تغییرات نشانگرهای زیستی در گردش آسیب قلبی (تروپونین I، NT-proBNP)، التهاب (پروتئین واکنشی C، فریتین)، ترومبوز (نسبت TCT، D-دایمر، فیبرینوژن، فاکتور VIII، آنتی ترومبین، پروتئین C، پروتئین S)، فعال شدن اندوتلیال ( فاکتور فون ویلبراند (vWF): GP1bR، VWF: Ag) و عملکرد کلیه (کراتینین سرم؛ میزان فیلتراسیون گلومرولی (GFR)، تخمین زده شده با استفاده از معادله اپیدمیولوژی بیماری مزمن کلیه (CKD-EPI) و نسبت آللوکالن ادرار: کراتینین) در طول زمان مورد بررسی قرار گرفت. اندازهگیریها در آزمایشگاههای مرکزی، بدون توجه به سایر دادههای بالینی انجام شد.
نمونه های پلاسمای EDTA در دمای ۸۰- درجه سانتی گراد در مخزن زیستی گلاسکو تا تجزیه و تحلیل دسته ای در پایان مطالعه ذخیره شدند. آنالیزهای بیوشیمیایی در مرکز تحقیقات قلب و عروق بنیاد قلب بریتانیا در گلاسکو انجام شد. نمونههای پلاسمای EDTA برای تجزیه و تحلیل تروپونین I و NT-proBNP قلبی با حساسیت بالا ذخیره شدند. تروپونین I (ng ml-1) و NT-proBNP (pg ml-1) در نمونه های خون جمع آوری شده در ویزیت ۱ و بازدید ۲ اندازه گیری شد. NT-proBNP (pg ml-1) برای ارائه یک اندازه گیری بیوشیمیایی برای بررسی بطن چپ اندازه گیری شد (تغییر درون بیمار در NT-proBNP در پیگیری از ابتدا) و تروپونین I نیز برای ارائه اندازهگیری بیوشیمیایی نکروز میوکارد اندازه گیری شد.
برای اندازهگیری NT-proBNP و تروپونین I قلبی با حساسیت بالا، از یک روش خودکار (i1000SR ARCHITECT، Abbott Diagnostics)، کالیبرهشده و کنترلشده با کیفیت با استفاده از معرفهای سازنده استفاده کردیم. ما همچنین در طرح ملی تضمین کیفیت خارجی (NEQAS) شرکت کردیم. حد تشخیص تروپونین I 0.0012 ng ml-1 است و مقدار صدک ۹۹ در یک زیرجمعیت سالم ۰.۰۲۶۲ ng ml-1 است. ضریب تغییرات بین سنجش برای مواد کنترل با میانگین غلظت تروپونین I به ترتیب ۱۵.۴۳ ng ml-1 و ۰.۰۱۵ ng-ml-1 3.7٪ و ۷.۱٪ بود.
برای NT-proBNP، ضریب تغییرات برای مواد کنترل ۳.۶٪ و ۵.۵٪ با میانگین سطح NT-proBNP به ترتیب ۵۱۴۱ pg ml-1 و 139pg ml-1 بود. نتایج تروپونین I و NT-proBNP به مرکز آمار زیستی رابرتسون در دانشگاه گلاسکو ارائه شد.
نشانگرهای هموستاز
جابجایی نمونه
تمام نمونههای پلاسما سیترات سدیم به روشی غیراستاندارد با استفاده از نمونههای بارکد ناشناس توسط یکی از کارکنان آموزش دیده در مخزن زیستی گلاسکو پردازش شدند. نمونههای پلاسمای منجمد متعاقباً روی یخ خشک برای تجزیه و تحلیل آزمایشگاهی مرکزی در بخش هماتولوژی در بیمارستان سلطنتی گلاسکو منتقل شدند. این آزمایشگاه از نظر خدمات اعتباربخشی انگلستان معتبر است. نمونههای پلاسما تا زمان تجزیه و تحلیل در دمای ۸۰- درجه سانتیگراد نگهداری شدند و نمونههای باقیمانده برای ذخیرهسازی در پایان مطالعه به مخزن بیولوژیک گلاسکو منتقل شدند. آنالیزهای بیوشیمیایی در مرکز تحقیقات قلب و عروق بنیاد قلب بریتانیا در گلاسکو انجام شد
سنجش ها
تمام سنجشهای آزمایشگاهی هموستاز با استفاده از معرفهای Werfen بر روی آنالایزر Werfen ACL TOP 550/750 یا Werfen ACL AcuStar (فقط VWF:GP1bR) مطابق با دستورالعملهای سازنده با استفاده از یک مقدار معرف Werfen انجام شد. صفحه انعقاد شامل سنجش زمان پروترومبین (PT)، سنجش زمان پروترومبین جزئی فعال (APTT)، سنجش زمان لخته شدن ترومبین (TCT) و سنجش فیبرینوژن کلاوس با محدوده مرجع طبیعی به ترتیب ۹-۱۳ ثانیه، ۲۷-۳۶ ثانیه، ۱۱-۱۵ ثانیه و ۱.۷-۴ اینچ گرم در L-1 (همه از داخل مشتق شده اند) بود. سنجش فیبرین دی-دایمر (ایمونواسی لاتکس) محدوده مرجع <230 ng ml-1 (مشتق شده توسط سازنده) داشت. سنجش FVIII یک مرحلهای با استفاده از معرف SynthASil (ورفن) انجام شد و دارای محدوده ۵۸-۱۵۲ IU dl-1 بود. VWF: Ag (ایمونواسی لاتکس) و سنجش فعالیت VWF: GP1bR (ایمونواسی نورتابی شیمیایی) به ترتیب دارای محدوده مرجع ۵۱-۱۷۰ IU dl-1 و ۵۲-۱۷۲ IU dl-1 (مشتق شده از داخل) بود. فعالیت آنتی ترومبین (کروموژنیک)، پروتئین آزاد S (ایمونواسی لاتکس) و سنجش فعالیت پروتئین C (کروموژنیک) دارای محدوده مرجع ۸۲-۱۲۳ IU dl-1، ۷۵-۱۳۷ IU dl-1 و ۷۱-۱۴۶ dl-1، IU بود. سنجشهای آزمایشگاهی هموستاز پس از انجام بررسیهای کنترل کیفی داخلی با استفاده از مواد کنترلی قابل ردیابی با استانداردهای بینالمللی، مطابق با روشهای عملیاتی آزمایشگاهی استاندارد تکمیل شد. علاوه بر این، تمام روششناسی مورد استفاده برای اهداف این مطالعه به طور منظم تحت بررسیهای کنترل کیفیت خارجی از طریق طرح بینالمللی شناختهشده، UKNEQAS است. نتایج آزمایشگاهی مستقیماً در اختیار مرکز آمار زیستی رابرتسون در دانشگاه گلاسکو قرار گرفت.
تصویربرداری چند وجهی
بررسی اجمالی
سی تی روش مرجع برای تصویربرداری از قفسه سینه است و سی تی آنژیوگرافی عروق کرونر و ریه به ترتیب تکنیک های مرجع برای تصویربرداری از عروق کرونر و گردش خون ریوی هستند. MRI قلب و عروق برای تصویربرداری آسیب میوکارد توصیه می شود. MRI قلب و کلیه در یک سایت مرجع انجام شد: مرکز عالی تصویربرداری، بیمارستان دانشگاه کوئین الیزابت، دانشگاه گلاسکو. این مطالعه به منظور به حداقل رساندن تغییرات اندازهگیری که ممکن است در طول اکتساب و تجزیه و تحلیل تصویربرداری ایجاد شود، طراحی شده است. از همه بیماران به جای اسکنرهای مختلف خدمات بیمارستانی، روی همان اسکنرهای MRI و سی تی اسکن اختصاصی تحقیق تصویربرداری شد. همه بیماران ۲۸ تا ۶۰ روز پس از ترخیص تصویربرداری شدند. منطق انجام MRI در این مقطع زمانی، ارزیابی شواهد پایدار آسیب قلبی-کلیوی در مرحله نقاهت بود، زمانی که خطر انتقال عفونت به کارکنان حداقل بود.
CT Scan
یک اسکنر سی تی ردیاب ۳۲۰ (Aquilion ONE، Canon Medical Systems) پوشش کامل قلب را در یک ضربان قلب فراهم می کند. متوپرولول داخل وریدی در مواردی که برای کنترل ضربان قلب مورد نیاز بود استفاده شد (هدف، ۶۰ ضربه در دقیقه (bpm))، و گلیسریل تری نیترات زیرزبانی بلافاصله قبل از گرفتن اسکن به همه بیماران داده شد. یک اسکن اسپایرال با دوز کم تشعشع اولیه از قفسه سینه برای ارزیابی جامع ریه ها به دست آمد. یک اسکن با زمان بندی بولوس کنتراست برای ارائه اطلاعات در مورد زمانبندی گردش قلبی ریوی به دست آمد. حجمهای بدون کنتراست و کنتراست افزایشیافته در آنژیوگرافی حین حبس نفس با ECG به دست آمد و برای Opacity بهینه شریان ریوی و سیستمیک (کرونری) زمانبندی شد. بیماران مبتلا به اختلال عملکرد کلیوی شدید تحت CT بدون کنتراست قرار گرفتند.
سی تی آنژیوگرافی کرونر اطلاعاتی را در مورد وجود و میزان کلسیفیکاسیون کرونر ، بیماری عروق کرونر و اینکه آیا بیماری عروق کرونر انسدادی (محدود کننده جریان) بود یا خیر، از جمله سیستم گزارش بیماری عروق کرونر و داده ها (CAD-RADS) ارائه کرد. اهمیت عملکردی بیماری عروق کرونر با استفاده از CT ذخیره جریان کسری (FFRCT؛ HeartFlow) ارزیابی شد. یک FFRCT ≤ ۰.۸۰ بیماری انسدادی عروق کرونر را تعریف می کند، که کمترین مقدار را در رگ اندازه می گیرد. اندازهگیریهای FFRCT در نقاط از پیش تعیینشده با استفاده از تعاریف استاندارد بخش کرونری به عنوان مرجع انجام شد. مقادیر متوسط FFRCT به ترتیب برای شریانهای کرونری نزولی قدامی چپ، سیرکومفلکس و راست در ترکیب با عروق فرعی (یعنی شریانهای مورب و شریانهای حاشیهای منفرد) محاسبه شد. مقادیر FFRCT در سطح بیمار شامل تمام این شریانهای کرونر میشود.
تصویربرداری عروق ریوی ترومبوز شریانی (آمبولی) را ارزیابی کرد. CT برای مشخص کردن ویژگیهای ریوی مرتبط با عفونت کووید – به عنوان مثال، آتلکتازی، Ground Glass و آسیبهای ریوی از قبل موجود – به عنوان مثال، آمفیزم استفاده شد. یافتههای قلبی و خارج از قلب گزارش شد و طبق استانداردهای محلی مراقبت مدیریت شد.
MRI قلب و عروق
بیماران با استفاده از یک اسکنر MRI 3.0 تسلا (3T) اختصاصی تحقیقات بالینی (MAGNETOM Prisma، Siemens Healthineers) با دو سیم پیچ سطحی ۱۸ کانالی در جلو و یک سیم پیچ ستون فقرات ۳۲ کانالی در پشت در فاز نقاهت اسکن شدند.
از توالیهای متوازن حالت پایدار آزاد (SSFP) برای به دست آوردن تصویربرداری سینمایی بطنی در سه صفحه محور بلند، و به دنبال آن یک پشته محور کوتاه از راس تا حلقه دهلیزی-بطنی، هر کدام با ۳۰ فاز، استفاده شد. پارامترهای اسکن معمولی عبارت بودند از: میدان دید (FOV)، ۳۴۰ × ۲۸۶ mm. ضخامت برش، ۷ میلی متر، با شکاف ۳ میلی متری در پشته محور کوتاه؛ زمان تکرار (TR)، ۴۱.۴ اینچ؛ زمان اکو (TE)، ۱.۵۱ اینچ؛ زاویه چرخش، ۵۰ درجه؛ و اندازه وکسل، ۱.۳۳ × ۱.۳۳ × ۷ mm.
سه محور کوتاه بطن چپ (پایه، میانی و اپیکال) و یک محور طولانی متعامد زمان استراحت طولی (T1، ثابت زمان آرامش اسپین-شبکه بر حسب میلی ثانیه) توالی های بازیابی وارونگی Look-Locker اصلاح شده با حرکت اصلاح شده، بهینه شده و اصلاح شده با موارد زیر به دست آمد. پارامترهای معمولی: FOV، ۳۶۰ × ۳۰۶ mm. ضخامت برش، ۸.۰ میلی متر؛ اندازه وکسل، ۱.۹ × ۱.۹ × ۸.۰ mm؛ TR، ۲۶۴ اینچ؛ TE، ۱.۱۲ اینچ؛ زاویه چرخش، ۳۵ درجه؛ حداقل T1، ۱۰۰ اینچ؛ افزایش زمان وارونگی، ۸۰ میلیثانیه؛ و پهنای باند، ۱۰۸۵ اینچ هرتز در هر پیکسل.
یک پشته محور کوتاه از زمان آرامش عرضی نقشهها و نماهای محور طولانی متعامد به دست آمد، که به دنبال آن یک تناسب نمایی خودکار برای هر پیکسل پس از اصلاح حرکت تنفسی به دست آمد. در تصویربرداری از یک بازخوانی SSFP تک شات آماده شده با T2 با زمان های آماده سازی T2 (TE) = ۰، ۲۵ و ۵۵ اینچ، با دوره بهبودی سه ضربان قلب بین اندازه گیری ها استفاده شد. پارامترهای پروتکل معمولی برای نقشه برداری T2 عبارتند از: FOV، ۳۶۰ × ۲۷۰ mm. ضخامت برش، ۸ میلی متر؛ ماتریس، ۱۹۲ × ۱۱۶؛ وضوح فضایی، ۱.۹ × ۱.۹ mm. TR، ۲۰۷.۳۹ اینچ؛ TE، ۱.۳۲ اینچ؛ زاویه چرخش، ۱۲ درجه؛ و پهنای باند، ۱۱۸۴ اینچ هرتز در هر پیکسل.
تصاویر تقویتی تاخیری گادولینیوم، از جمله سه محور طولانی و یک پشته محور کوتاه، ۱۰ تا ۱۵ دقیقه پس از تزریق داخل وریدی ۰.۱۵ میلی مول بر کیلوگرم-۱ گادولینیم دی اتیل تریامین پنتا استیک اسید (Gd-DTPA، با استفاده از فاز Magnete-DTPA، با استفاده از Magazine Health Bayer, Magazine)، به دست آمد. پارامترهای تصویربرداری معمولی عبارتند از: ماتریس، ۱۹۲ × ۱۱۱. زاویه چرخش، ۱۴ درجه؛ TE، ۱.۰۵ اینچ؛ پهنای باند، ۱۰۸۵ اینچ هرتز در هر پیکسل؛ فاصله اکو، ۲.۱ اینچ؛ و پالس ماشه، ۱ اینچ. اندازه وکسل ۱.۹ × ۱.۹ × ۷ mm3 بود. سه محور کوتاه بطن چپ (پایه، میانی و اپیکال) و محور بلند متعامد T1 که با حرکت تصحیح شده، بهینهسازی شده و اصلاحشده بازیابی وارونگی Look-Locker انجام شد، ۱۵ دقیقه پس از تجویز کنتراست با پارامترهای معمول زیر بدست آمد: FOV، ۳۶۰ ۶× ۰; ضخامت برش، ۸.۰ میلی متر؛ اندازه وکسل، ۱.۹ × ۱.۹ × ۸.۰ mm؛ TR، ۳۴۱ اینچ؛ TE، ۱.۰۱ اینچ؛ زاویه چرخش، ۳۵ درجه؛ حداقل T1، ۱۰۰ اینچ؛ افزایش زمان وارونگی، ۸۰ میلیثانیه؛ و پهنای باند، ۱۰۸۵ اینچ هرتز در هر پیکسل.
تجزیه و تحلیل MRI قلب و عروق
اسکن های MRI قلب و عروق توسط یک رادیولوژیست معتبر (G.R. با بیش از ۱۵ سال تجربه تجزیه و تحلیل تصویر) بررسی و گزارش شد. یک تحلیلگر تصویر منفرد (K.M. با> 8 سال تجربه تجزیه و تحلیل تصویر) همه داده ها را تجزیه و تحلیل کرد که متعاقباً توسط C.B مورد بررسی قرار گرفت (با بیش از ۱۵ سال تجربه تجزیه و تحلیل تصویر).
محدوده های مرجع
محدوده مرجع محلی و معاصر با استفاده از اسکنر MRI 3T (MAGNETOM Prisma، Siemens Healthineers) در طول دوره مشابه مطالعه حاضر به دست آمد و با استفاده از نرمافزار اختصاصی (نرمافزار cvi42 برای MRI قلب و عروق، نسخه ۵.۱۰، Circle Cardiovascular) برای استخراج میانگینها، محدوده مرجع حداکثر و حداقل مورد تجزیه و تحلیل قرار گرفت. این بسته نرم افزاری همچنین برای آنالیز MRI قلب و عروق شرکت کنندگان در مطالعه استفاده شد.
عملکرد بطنی
آنالیزهای تصویربرداری با استفاده از نرم افزار اختصاصی MRI قلب و عروق (نرم افزار cvi42 (نسخه ۵.۱۰، Circle Cardiovascular) انجام شد. اندازهگیریهای معمول گزارش شده از عملکرد بطن چپ و بطن راست طبق دستورالعملهای معاصر انجام شد. خطوط اندوکارد و اپی کاردیال بطنی به صورت دستی در انتهای دیاستول و انتهای سیستول،ترسیم شد. عضلات پاپیلاری از توده میوکارد حذف و در حجم گنجانده شدند. کرنش کلی بطن چپ (محیطی، طولی و شعاعی) و کرنش کلی بطن راست (طولی) با استفاده از ماژول ردیابی بافت نرم افزار برای تعیین مقادیر پیک برای هر پارامتر استخراج شد. نواحی دهلیزی به صورت دستی بر روی نماهای محور بلند افقی چهار حفره ای در دیاستول دهلیزی (تعریف شده با توجه به بسته شدن دریچه میترال) کشیده شد.
نقشه برداری پارامتریک
اسکن های T1 و T2 تصحیح شده با حرکت با استفاده از نرم افزار اختصاصی (نرم افزار cvi42 (نسخه ۵.۱۰، Circle Cardiovascular) مورد تجزیه و تحلیل قرار گرفت. تک تک تصاویر برای اطمینان از موفقیت آمیز بودن تصحیح حرکت بررسی شدند. نقشه های پارامتری تولید شد و میوکاردهای با آرتیفکتهایی که کیفیت تشخیصی و/یا دقت اندازهگیری را مختل میکردند، از جمله پیکسلها/بخشهای با R2 < ۰.۹۹، از تجزیه و تحلیل حذف شدند.
مرزهای اپیکارد و اندوکارد به صورت دستی ترسیم شدند و فقط بافت میوکارد با افست اپی کاردیال و اندوکارد ۱۰% اعمال شد تا از اثرات حجمی جزئی جلوگیری شود. نقاط درج شده بطن راست برای تقسیم بندی میوکارد طبق مدل بطن چپ بخش انجمن قلب آمریکا استفاده شد. برای مخزن خون قبل از کنتراست و پس از کنتراست T1، مناطق مورد نظر در داخل حفره بطن چپ بر روی سه نقشه محور کوتاه، با مراقبت برای جلوگیری از آرتیفکت و عضلات پاپیلاری ترسیم شد.
مقادیر هماتوکریت در روز بازدید مطالعه به دست آمد. مناطق مورد علاقه اضافی به صورت دستی بر روی یک ناحیه نماینده سراتوس قدامی، که از پشته T2 شناسایی شده است، کشیده شد.
تصویربرداری تاخیری افزایش گادولینیوم
آرشیو تصاویر افزایش تاخیری گادولینیوم برای هر بیمار در ابتدا از نظر کیفیت تصویر و مصنوعات مورد بررسی کیفی قرار گرفت. مجموعه تصویربرداری شامل پشته محور کوتاه و سه یا چند نمای محور بلند متعامد بود.
الگوهای گادولینیم دیررس میوکارد از پیش تعریف شده بودند. آنها شامل میوکاردیت، انفارکتوس میوکارد، کاردیومیوپاتی غیر ایسکمیک و ترومبوز میکروواسکولار بودند. محل افزایش گادولینیم در ساب آندوکاردیال، دیواره میانی، فوق اپیکارد یا پریکارد تعریف شد. افزایش وضوح بیش از حد میوکارد در سپتوم پایه در بازسازی تصویر CT قلب مورد بررسی قرار گرفت، و در صورت سازگاری با شریان سوراخکننده سپتوم، این ویژگی از تجزیه و تحلیلهای افزایش گادولینیوم اواخر حذف شد. افزایش بیش از حد وضوح در نقاط درج بطن راست ممکن است در افراد بدون بیماری قلبی مشاهده شود. بنابراین، این ویژگی به عنوان آسیب شناسی تعریف نشد.
تکنیک پهنای کامل در نصف حداکثر (FWHM) برای ارزیابی تصویربرداری افزایش گادولینیوم دیررس میوکارد بر اساس بررسی متون توسط K.M. مورد استفاده قرار گرفت، زیرا گزارش شده است که این روش بسیار تکرارپذیر است و کمتر منجر به “گزارش بیش از حد” وسعت افزایش تاخیری گادولینیوم در مقایسه با روش های دیگرمیشود. تکنیک FWHM به عنوان روش کمی سازی نیمه خودکار بهینه در بیماران مشکوک به میوکاردیت دارای طبقه بندی خطر توصیف می شود که قوی ترین ارتباط را با حوادث نامطلوب قلبی عمده نشان می دهد. افزایش دیررس گادولینیوم بر اساس الگوی (توزیع) هر بخش و هر بیمار گزارش شد. دسته بندی های سببشناختی الگوی افزایش دیررس گادولینیوم شامل غیر ایسکمیک، ایسکمیک، مخلوط، میکروترومبی، سایر یا هیچکدام بود. افزایش دیررس گادولینیوم به عنوان درصد توده بطن چپ اندازه گیری شد.
پروتکل MRI کلیه
MRI چند پارامتری کلیه شامل تصویربرداری تشریحی و نقشه برداری T1 و T2 لوکال بود. حجم (ml)، T1 لوکال (ms) و T2 (ms) در نواحی مورد علاقه بهدستآمده در قشر و مدولای هر کلیه ثبت شد و سپس مقادیر میانگین این پارامترها برای هر دو کلیه تعیین شد. تمایز کورتیکومدولاری منعکس کننده تفاوت در کنتراست بافتی در تصویربرداری با وزن T1 به دلیل زمان کوتاهتر آرام شدن T1 قشر نسبت به بصل النخاع است که این مساله به تفاوت در محتوای آب بین بیماری دو بافت نسبت داده می شود. تمایز کورتیکومدولاری، که در اینجا به عنوان نسبت قشر T1 تقسیم بر T1 مدولا گزارش شده است، ممکن است در بیماری کلیوی کاهش یابد.
تصاویر معاینه حبس نفس درون یابی شده عرضی (VIBE)، با و بدون کنتراست، برای ارزیابی حجم کلیه به دست آمد. برای توالیهای T1 و T2، برشهای کرونال و ابلیک منفرد که از طریق مرکز هر دو کلیه قرار گرفتهاند، با تنفس در هنگام بازدم به دست آمدند. در بیمارانی که هر دو کلیه آنها توانند به وضوح نشان داده نمیشود، کلیه راست در اولویت قرار گرفت.
نقشههای T1 با استفاده از یک توالی بازیابی وارونگی Look-Locker (MOLLI) با بازخوانی واقعی FISP تک شات به دست آمد. تصاویر در هشت زمان وارونگی مختلف (الگوی ۵(۳)۳) با TI شروع ۱۸۰ میلیثانیه و افزایش TI 80 میلیثانیه به دست آمد. تصحیح حرکت و برازش نقشه T1 با استفاده از بازسازی بازیابی وارونگی حساس به فاز اجرا شده در نرم افزار vendor (VE11C، Myomaps، زیمنس) انجام شد. سایر پارامترهای تصویربرداری عبارت بودند از: FOV، ۳۶۰ × ۲۱۳ mm. ضخامت برش، ۵ میلی متر؛ ماتریس، ۲۴۰ × ۱۹۰؛ وضوح فضایی، ۱.۵ × ۱.۵ mm. TE، ۱.۲ اینچ؛ زاویه چرخش، ۳۵ درجه؛ و پهنای باند، ۱۰۹۶ اینچ هرتز در هر پیکسل. پروتکل T1 اولیه از یک TR 550 اینچ (که TIهای ۱۳۰، ۲۱۰، ۶۸۰، ۷۶۰، ۱،۲۳۰، ۱،۳۱۰، ۱،۷۸۰ و ۲،۳۳۰ میلیثانیه را تولید میکند) به اشتباه استفاده کرد. توالی نگاشت ترجیحی T1 دارای TR 1000 میلیثانیه برای تولید طیف وسیعتری از TI بود (۱۳۰، ۲۱۰، ۱۱۳۰، ۱۲۱۰، ۲۱۳۰، ۲۲۱۰، ۳۱۳۰ و ۴۱۳۰ اینچ). پس از اصلاح، همه شرکتکنندگان بعدی با استفاده از پروتکلهای TR 550-ms و TR 1000-ms اسکن شدند. در صورت وجود، TR 1000 میلیثانیه ترجیحاً در تجزیه و تحلیل استفاده شد، اما شرکتکنندگانی که فقط تصاویر TR 550 میلیثانیه داشتند نیز مستثنی نشدند.
نقشههای T2 با استفاده از یک توالی اکو گرادیان بازیابی وارونگی سریع با زاویه پایین (FLASH) با TR، ۳۸۹ میلیثانیه به دست آمد. TE، ۱.۴ اینچ؛ضخامت برش، ۵ میلی متر؛ FOV، ۳۶۰ × ۲۱۳ mm؛ ماتریس، ۲۴۰ × ۱۸۲؛ و وضوح فضایی، ۱.۵×۱.۵ میلی متر.
تصاویر T1 VIBE با استفاده از توالی اکو گرادیان بازیابی وارونگی FLASH با TR، ۳.۱ اینچ به دست آمد. TE، ۱.۲۲ اینچ؛ اشباع چربی بازیابی وارونگی ضعیف شده طیفی (SPAIR). ضخامت برش، ۱.۵ میلی متر؛ FOV، ۳۸۰ × ۳۰۸ mm؛ ماتریس، ۲۵۶ × ۱۹۲؛ و وضوح فضایی ۱.۵ × ۱.۵ mm.
تجزیه و تحلیل MRI کلیه
تجزیه و تحلیل تصویربرداری با استفاده از یک ماکرو ImageJ سفارشی (ImageJ, National Institutes of Health) توسط K.J.M., P.H.B انجام شد. یک تکنیک آستانهسازی روی نقشههای MRI T1 کلیه برای بخشبندی قشر و مدولا، ایجاد دو ناحیه برای T1 (ms)، به استثنای پلویس کلیه، اعمال شد. این مناطق بر روی نقشههای MRI T2 کلیه قرار گرفتند که امکان اندازهگیری T2 (ms) را فراهم میکرد. تمایز کورتیکومدولاری کلیه با تقسیم مقادیر قشر بر مقادیر مدولا محاسبه شد. حجم کل کلیه (ml) با ردیابی دستی کلیه بر روی چند برش برای تعیین ناحیه ای که نرم افزار در ضخامت برش برای تعیین حجم ضرب می کند، تعیین شد. به طور کلی، مقادیر میانگین اندازهگیریها برای هر کلیه برای نشان دادن مقادیر چپ و راست گرفته شد.
Blinding
اقدامات Blinding برای به حداقل رساندن سوگیری از پیش تعریف شده بود. بیماران قبل از انجام اسکن، پرسشنامه های وضعیت سلامت را تکمیل کردند و از نتایج اسکن بی اطلاع بودند. ارزیابان آنالیزهای آزمایشگاهی مرکزی به طور مستقل کار کردند. به طور خاص، رادیولوژیستهایی که اسکنهای MRI و CT را گزارش میکنند، از نتایج سایر روشهای تحقیقاتی – یعنی ECG، بیومارکرهای خون و پرسشنامهها بیاطلاع بودند. به همین ترتیب، محققانی که ECG، FFRCT و آنالیزهای آزمایشگاهی را انجام دادند از یافته های تصویربرداری بی اطلاع بودند. متخصص قلب و عروق (K.M.) آنالیزهای کمی MRI در آزمایشگاه اصلی را بر روی اسکن های ناشناس در یک ایستگاه اختصاصی، بدون دسترسی به داده های بالینی دیگر انجام داد. متخصص قلب که خواندن ثانویه (C.B) اسکنهای MRI را انجام داد، نسبت به دادههای مطالعه Blind شد. متخصصان قلب که پانل قضاوت بالینی را تشکیل دادند، از معیارهای پیامد گزارش شده توسط بیمار بی اطلاع بودند. آنها همچنین از قضاوت سایر اعضای هیأت نیز بی اطلاع بودند.
دستاوردها
نتیجه اولیه
پیامد اولیه از پیش تعریف شده تشخیص میوکاردیت بود که زیر گروه آسیب حاد میوکارد است.
تشخیص میوکاردیت مستعد امری گیج کننده به علت سوگیری در تشخیص است. مطالعات اخیر در مورد COVID-19 از معیارهای تشخیصی تغییر یافته Lake Louise پیروی نکرده است. بر این اساس، برای محدود کردن پتانسیل سوگیری، یک پروتکل تشخیصی را برای نتیجه اولیه از پیش تعیین کردیم که شامل حضور گروهی از متخصصان قلب با تجربه است. بررسی های پانل بر اساس یک منشور از پیش تعیین شده انجام شد.
معیارهای تشخیصی میوکاردیت شامل معیارهای تست بالینی و تشخیصی مربوطه بود. یافتههای بالینی مثبت شامل درد قفسه سینه، پریکاردیت یا شبه ایسکمیک بود. شروع جدید تنگی نفس؛ تنگی نفس تحت حاد/مزمن؛ تپش قلب؛ آریتمی غیر قابل توضیح؛ سنکوپ سقط مرگ ناگهانی قلبی؛ و شوک قلبی غیر قابل توضیح بود. یافته های تست مثبت شامل (۱) ویژگی های ECG. (2) تروپونین I افزایش یافته (حد مرجع بالای صدک ۹۹ بالای جنسیت: زن: > 16 ng L-1، مرد: > 34 ng L-1؛ سنجش Abbott Architect STAT TnI). (3) ناهنجاری های عملکردی و ساختاری در تصویربرداری قلب (اکوکاردیوگرافی، آنژیوگرافی یا MRI). و (۴) MRI توصیف بافتی، از جمله ادم میوکارد و افزایش دیررس گادولینیوم با توزیعی در راستای معیارهای تشخیصی Lake Louise اصلاح شده برای میوکاردیت بود. همچنین آسیب شناسی حاد و مزمن میوکارد را می توان با استفاده از MRI شناسایی، تفکیک و تعیین کرد.
اگر حداقل یک یافته بالینی و حداقل یک معیار تست تشخیصی از دستههای مختلف مشاهده میشد که باید در شرایط زیر باشد: در غیاب (۱) بیماری عروق کرونر قابل تشخیص آنژیوگرافی (تنگی عروق کرونر ≥۵۰%) و (۲) بیماری قلبی عروقی یا علل خارج از قلب از قبل شناخته شده که می تواند این سندرم را توضیح دهد (به عنوان مثال، بیماری دریچه، بیماری مادرزادی قلب یا پرکاری تیروئید). با افزایش تعداد معیارهای برآورده شده، احتمال وجود میوکارد افزایش می یابد. اگر بیمار بدون علامت بود، حداقل دو معیار تشخیصی لازم است.
قضاوت در مورد نتیجه اولیه
تشخیص میوکاردیت مستعد امری گیج کننده به علت سوگیری در تشخیص است. مطالعات اخیر در مورد COVID-19 از معیارهای تشخیصی تغییر یافته Lake Louise پیروی نکرده است. بر این اساس، برای محدود کردن احتمال سوگیری، یک پروتکل تشخیصی را برای نتیجه اولیه از پیش تعیین کردیم که شامل حضور گروهی از متخصصان قلب با تجربه است. بررسی ها بر اساس یک منشور از پیش تعیین شده انجام شد.
مشاوران قلب و عروق (n = ۱۴) که مستقل از تیم تحقیقاتی بودند به عنوان ارزیاب دعوت شدند. اطلاعاتی در مورد بیانیه گروه کاری انجمن قلب و عروق اروپا در مورد بیماری میوکارد و پریکارد ، منشور و موارد آموزشی به آنها ارائه شد. متخصصان قلب در مورد هویت بیماران و مراقبت های بالینی آنها بی اطلاع بودند. قضاوت ها توسط محقق (A.M.) با استفاده از نرم افزار Teams (Microsoft) همگام سازی شد.
هر متخصص قلب به طور مستقل داده های بالینی، از جمله تاریخچه پزشکی، بیومارکرها، ECG و گزارش های رادیولوژی CT قفسه سینه، سی تی آنژیوگرافی ریه، سی تی آنژیوگرافی عروق کرونر و MRI قلب را ارزیابی کرد. اطلاعات بالینی منبع شناسایی نشده (به عنوان مثال، تصاویر اسکن) در صورت درخواست در دسترس قرار گرفت. معیارهای تشخیصی به صورت کلمه به کلمه از گروه کاری انجمن قلب و عروق اروپا در مورد بیماری میوکارد و پریکارد رونویسی شده است. با میوکاردیت مشکوک بالینی اگر ≥۱ تظاهر بالینی و ≥۱ معیار تشخیصی از دسته های مختلف (یا ۲ معیار تشخیصی ≥ ۲ در بیماران بدون علامت نشان داده شود) ، در غیاب تنگی بیش از ۵۰٪ در عروق کرونر اپیکارد، مشاهده شد کسب کردند. معیارهای «تظاهرات بالینی» ۱ امتیاز برای درد حاد قفسه سینه (شبه ایسکمیک و پریکارد) دارند. شروع جدید یا بدتر شدن تنگی نفس یا خستگی (در حالت استراحت و در هنگام فعالیت) با یا بدون علائم نارسایی قلب راست یا چپ نیز تپش قلب / سنکوپ / مرگ ناگهانی قلبی سقط شده و شوک قلبی غیر قابل توضیح معیارهای تشخیصی شامل ۱ امتیاز هستند. (۱) ویژگی های ECG/Holter، از جمله بلوک دهلیزی-بطنی، بلوک شاخه ای و تاکی کاردی های فوق بطنی یا بطنی است (۲) افزایش نشانگرهای میوکاردوسیتولیز (به عنوان مثال، تروپونین). (۳) ناهنجاری های تصویربرداری عملکردی یا ساختاری در اکوکاردیوگرافی، MRI قلب یا بطن چپ. و (۴) خصوصیات بافت توسط MRI قلبی (معیارهای تغییر یافته لیک لوئیز) نیز یک امتیاز را در بر میگیرند.
هر متخصص قلب به طور مستقل احتمال (موجود نیست / بعید / محتمل / بسیار محتمل) التهاب میوکارد (میوکاردیت) را بر اساس تظاهرات بالینی و معیارهای تشخیصی خلاصه بر اساس هر بیمار تعیین می کند. به طور خاص، طبقه بندی احتمال میوکاردیت با امتیاز خلاصه این معیارها، از جمله ۱ امتیاز برای معیارهای بالینی و حداکثر ۴ امتیاز برای معیارهای تشخیصی مشخص می شود: “عدم وجود” = 0-۱، “بعید” = 2، ‘احتمال’ = 3 و ‘بسیار محتمل’ = 4 یا بیشتر. بنابراین، قضاوت بر اساس معیارهای تشخیصی خاص، مطابق با دستورالعملهای بالینی توزین شد.
هر مورد به طور مستقل توسط پنج متخصص قلب مورد قضاوت قرار گرفت. قضاوت برای هر شرکت کننده با هم جمع شد و تشخیص نهایی بر اساس هر شرکت کننده بر اساس احتمال متوسط مبنی بر قضاوت های پنج متخصص قلب بود. تعیین آنها نیز به شکل دودویی طبقهبندی شد (موجود نیست/بعید = خیر؛ محتمل/خیلی محتمل = بله).
موارد کنترل نیز مورد ارزیابی قرار گرفت و قضاوتها بدون توجه به وضعیت COVID-19 انجام شد. هر ارزیاب ۳۰ مورد را مجددا ارزیابی کرد تا تنوع را ارزیابی کند تا قابلیت اطمینان آزمون-آزمون مجدد را ارزیابی کند.
نتایج ثانویه
آسیب میوکارد بر اساس علت طبقه بندی شد. اندوتیپ های بالقوه عبارت بودند از:
- ۱. میوکاردیت SARS-CoV-2
- ۲. کاردیومیوپاتی استرس حاد
- ۳. ایسکمی میوکارد / اختلال در پرفیوژن به عنوان یک عامل استرس زا التهاب
- ۴.میوپریکاردیت عفونی (عفونت غیر کووید)
- ۵.التهاب میوکارد (سمی) ناشی از دارو
- ۶. میوکارد ایدیوپاتیک با یا بدون التهاب پریکارد
تعاریف
اندوتیپ های آسیب حاد میوکارد شامل انفارکتوس میوکارد طبق تعریف چهارم جهانی انفارکتوس میوکارد و میوکاردیت (التهاب میوکارد، ایسکمی یا کاردیومیوپاتی استرسی) است که در قالب پیامدهای ثانویه بودند.
تعاریف پیامدهای ثانویه
این تعاریف با راهنمایی های کارگروه ویژه مدیریت کووید-۱۹ انجمن اروپایی قلب و عروق، انفارکتوس حاد میوکارد، عروق عروق کرونر و گروه کاری بیانیه موضع انجمن قلب و عروق اروپا در مورد بیماری های میوکارد و پریکارد مطابقت دارد.
میوکاردیت ناشی از SARS-CoV-2
معیارهای تشخیصی برای میوکاردیت ویروسی مشکوک بالینی، از جمله تظاهرات بالینی و معیارهای تشخیصی، در جدول تکمیلی ۲ ارائه شده است. تشخیص میوکاردیت بالینی درصورت وجود ≥۱ تظاهر بالینی و ≥۱ معیار تشخیصی از دسته های مختلف در غیاب (۱) بیماری عروق کرونر با آنژیوگرافی قابل تشخیص (تنگی عروق کرونر ≥۵۰%) و (۲) بیماری قلبی عروقی از قبل موجود یا علل خارج از قلب که می تواند سندرم را توضیح دهد (به عنوان مثال، بیماری دریچه، بیماری مادرزادی قلب یا پرکاری تیروئید) تایید میشود. سوء ظن با تعداد معیارهای برآورده شده افزایش میابد. اگر بیمار بدون علامت باشد، ۲ معیار تشخیصی باید رعایت شود. این معیار با آگاهی از اینکه بیوپسی اندومیوکارد برای معیارهای ویروس شناسی به دلایل لجستیکی مربوط به ارائه خدمات در طول همه گیری در دسترس نخواهد بود، اتخاذ شد.
کاردیومیوپاتی استرس حاد
سندرم تاکوتسوبو: آسیب میوکارد ثانویه به اختلالات میوکارد بدون درگیری عروق کرونر. سندرم تاکوتسوبو با ناهنجاریهای خاص حرکت دیواره بطن چپ (به عنوان مثال، بالون کردن آپیکال) و عدم افزایش دیررس گادولینیوم همراه با ادم مشخص میشود. معیارهای تشخیصی در سند اجماع کارشناسان بین المللی در مورد سندرم تاکوتسوبو (قسمت اول) ارائه شده است:
ویژگی های بالینی، معیارهای تشخیصی و پاتوفیزیولوژی:
۱. بیماران اختلال عملکرد گذرا بطن چپ (هیپوکینزی، آکینزی یا دیسکینزی) را نشان می دهند که به صورت بالون شدن آپیکال یا ناهنجاری های حرکتی دیواره میانی، پایه یا لوکال ظاهر می شود. درگیری بطن راست نیز می تواند وجود داشته باشد. ناهنجاری حرکت دیواره منطقه ای معمولا فراتر از یک توزیع عروقی اپی کاردیال گسترش می یابد. با این حال، موارد نادری می تواند وجود داشته باشد که در آن ناهنجاری حرکتی دیواره منطقه ای در محدوده میوکارد که تحت فشار یک شریان کرونر است باشد (سندرم کانونی تاکوتسوبو).
۲. یک محرک احساسی، فیزیکی یا ترکیبی می تواند قبل از رویداد سندرم تاکوتسوبو وجود باشد، اما این امر الزامی نیست.
3. اختلالات عصبی (به عنوان مثال، خونریزی زیر عنکبوتیه، سکته مغزی / حمله ایسکمیک گذرا یا تشنج) و همچنین فئوکروموسیتوم ممکن است به عنوان محرک برای سندرم تاکوتسوبو عمل کنند.
4. ناهنجاری های جدید در ECG وجود دارد (ارتفاع قطعه ST، فرورفتگی قطعه ST، وارونگی موج T یا طولانی شدن QTc). با این حال، موارد در نادر هیچ گونه تغییر ECG وجود ندارد.
5. سطح بیومارکرهای قلبی (تروپونین و کراتین کیناز) در اکثر موارد به طور متوسط افزایش می یابد. افزایش قابل توجه پپتید ناتریورتیک مغز نیز شایع است.
6. بیماری انسدادی عروق کرونر یک تناقض در سندرم تاکوتسوبو نیست.
7. بیماران شواهدی از میوکاردیت عفونی ندارند.
8. زنان یائسه عمدتاً تحت تأثیر قرار می گیرند.
-ایسکمی میوکارد / اختلال در پرفیوژن به عنوان یک عامل استرس زا التهاب
در این مطالعه، ما از یک FFRCT ≤۰.۸۰ (آستانه ایسکمیک) در یک شریان کرونر اصلی یا یک شریان کرونر مسدود شده استفاده کردیم که توسط سیتی آنژیوگرافی کرونر نشان داده شد (رهنمودهای ESC revascularization).
- -میوپریکاردیت عفونی (عفونت غیر کووید)
- -التهاب میوکارد (توکسیک) ناشی از دارو
- -میوکارد ایدیوپاتیک با یا بدون التهاب پریکارد
پیامدهای کلیوی
عملکرد کلیه با استفاده از eGFR دوران نقاهت (CKD-EPI39) و آلبومینوری ارزیابی شد. MRI چند پارامتری کلیه در ۶۰-۲۸ روز اطلاعاتی را در مورد بیماری پارانشیم کلیه ارائه کرد.
وضعیت سلامت و معیارهای نتیجه گزارش شده توسط بیمار
پرسشنامه ها توسط شرکت کنندگان در هنگام ثبت نام (ویزیت ۱) و ۲۸ تا ۶۰ روز پس از آخرین قسمت مراقبت های بیمارستانی (ویزیت ۲) تکمیل شد. وضعیت سلامتی خود گزارش شده با استفاده از پرسشنامه عمومی EuroQOL EQ-5D-5L و پرسشنامه (Brief-IPQ) مورد ارزیابی قرار گرفت. برای ارزیابی اختلالات اضطرابی و افسردگی از پرسشنامه سلامت بیمار-۴ (PHQ-4) استفاده شد. شاخص وضعیت فعالیت دوک (DASI) برای ارزیابی حداکثر مصرف اکسیژن پیشبینیشده (ml/kg/min)، اندازهگیری ظرفیت هوازی، و ظرفیت عملکردی استفاده شد – نمره بالاتر نشاندهنده عملکرد فیزیکی بیشتر است. پرسشنامه بین المللی (IPAQ-SF) انواع و شدت فعالیت بدنی و زمان نشستن را که افراد به عنوان بخشی از زندگی روزمره خود انجام می دهند، اندازه گیری می کند. این امتیاز کل فعالیت بدنی را در دقیقه که معادل متابولیک در هفته است منعکس می کند.
پیگیری طولی برای نتایج بالینی
از شرکتکنندگان دعوت شد تا برای ارزیابیهای بعدی SAEها، از جمله مرگ و بستری مجدد و استفاده از منابع NHS، از جمله رویهها، بازدید از کلینیک سرپایی و نسخههای دارو، رضایت دهند. اعضای بالینی تیم تحقیقاتی سوابق سلامت الکترونیکی را بدون تماس شرکتکننده در راستای پروتکل و منشور از پیش تعریفشده ارزیابی کردند. SAE های قلبی عروقی و تنفسی به طور مستقل توسط کمیته رویداد بالینی مورد بررسی و قضاوت قرار گرفتند. رویدادها با هماهنگی واحد آزمایشات بالینی وارد پایگاه داده شدند.
آمار
تجزیه و تحلیل های آماری در یک طرح پیش تعریف شده وجود داشتند. روش های آماری در جداول شرح داده شده است.
محاسبه اندازه نمونه
پیامد اولیه میوکاردیت (التهاب میوکارد) بود، و تجزیه و تحلیل اولیه نسبت بیماران با پیامد اولیه را با ویزیت ۲ تعیین کرد. احتمال میوکاردیت بر اساس احتمال میانه از کمیته قضاوت بالینی تعیین شد. برای تشخیص ارتباط بین سابقه بیماری قلبی عروقی از قبل موجود و التهاب میوکارد (میوکاردیت)، شیوع بیماری قلبی عروقی قبلی را ۲۵ درصد در جمعیت مورد مطالعه فرض کردیم و بروز التهاب میوکارد در افراد با یا بدون بیماری قلبی عروقی قبلی به ترتیب ۳۳ و ۱۰ درصد محاسبه شد. برای داشتن ۸۰ درصد قدرت برای تشخیص این تفاوت، ما محاسبه کردیم که ۱۴۰ شرکت کننده (۳۵ با مشکلات قلبی، ۱۰۵ بدون) با اطلاعات کامل مورد نیاز است. با پیش بینی اینکه ۱۰ تا ۱۵ درصد از شرکت کنندگان ممکن است تصویربرداری ناقص داشته باشند (به عنوان مثال، مصنوعات یا کلاستروفوبیا)، حجم نمونه مورد نظر برای تکمیل بازدید تصویربرداری ۱۶۰ بود.
آنالیزهای زیر گروهی از پیش تعیین شده برای بیماران بدون بیماری قلبی عروقی در نظر گرفته شده است، همانطور که با عدم وجود (۱) بیماری قلبی عروقی قبلی و (۲) بیماری انسدادی عروق کرونر در CT آنژیوگرافی کرونر تعریف شده است. وضعیت بیماری قلبی عروقی با (۱) سابقه قبلی بیماری قلبی عروقی و (۲) درمان از پیش انجام شده تعیین و تعریف شد. ارتباط بین غلظتهای در گردش بیومارکرها، پیامدهای گزارششده توسط بیمار و تغییرات آنها در طول زمان و پیامدهای اولیه و ثانویه ارزیابی شد. آزمونهای معنیداری با مقادیر P دو طرفه با فواصل اطمینان برای اندازههای اثر تخمینی و معیارهای ارتباط همراه هستند. عرض فواصل اطمینان برای تعدد تنظیم نشده است. مقادیر P برای تفاوت های زیرگروهی به ترتیب با استفاده از آزمون دقیق فیشر و آزمون کروسکال-والیس برای داده های طبقه بندی و پیوسته محاسبه شد. مقادیر P کمتر از ۰.۰۵ از نظر آماری معنی دار در نظر گرفته شد.
مدیریت کارازمایی و جدول زمانی
این مطالعه در راستای دستورالعملهای فعلی جهت ایجاد عملکرد مناسب بالینی در کارآزماییهای بالینی و دستورالعملهای STROBE69 انجام شد. یک گروه مدیریت مطالعه شامل افرادی بود که مسئول مدیریت روزانه مطالعه بودند، از جمله محقق ارشد، مدیر پروژه و نمایندگانی از آزمایشگاه های علمی. وظیفه های این گروه شامل تسهیل مطالعه، اطمینان از رعایت پروتکل و انجام اقدامات مناسب برای حفاظت از شرکت کنندگان و کیفیت خود مطالعه بود. تصمیم گیری در مورد ادامه یا خاتمه مطالعه یا اصلاحات اساسی در پروتکل بر عهده اسپانسر بود. گروه مدیریت مطالعه در فواصل زمانی هفتگی از مه ۲۰۲۰ تا اکتبر ۲۰۲۱ تشکیل جلسه داد.
یک گروه راهبری علمی بر این مطالعه نظارت کلی داشت. این مطالعه برای انجام و گزارش سریع در پاسخ به نیاز جهانی به اطلاعات در مورد COVID-19 طراحی شده است.
اخلاق
این مطالعه توسط سرویس اخلاق پژوهشی ملی انگلستان (مرجع ۲۰/NS/0066) تایید شده است.
