اکسیژن درمانی هایپرباریک آنسفالومیلیت خود ایمنی را از طریق کاهش تولید IL-17a و GM-Csf سلول های T خود واکنشی و همچنین تقویت سرکوبگر IL-10 در ضایعات بافتی سیستم عصبی مرکزی کاهش می دهد.
معرفی
مولتیپل اسکلروزیس (MS) یک بیماری خودایمنی مزمن و غیرقابل درمان سیستم عصبی مرکزی (CNS) است که با دمیلیناسیون عصبی و آسیب عصبی-آکسونال و ارتشاح سلول های تک هسته ای ظاهر می شود. علت MS هنوز نامشخص است اما به طور بالقوه با عوامل محیطی و عوامل ژنتیکی مرتبط است. شایعترین زیرگروه ام اس، مولتیپل اسکلروزیس عودکننده- فروکشکننده (RRMS) است که در آن علائم بالینی بیماران اماس معمولاً به صورت عودکننده و فروکشکننده ظاهر میشوند و در ادامه عمدتاً جوانان را به سمت بیماریهای ناتوان کننده سوق میدهد. ایمونوپاتولوژی MS عمدتاً به عدم تعادل در فعالیت سلول های T خودواکنشی نسبت داده می شود که مقادیر بیشتری از سایتوکین های پیش التهابی و همچنین سطوح پایین تری از سیتوکین های سرکوب کننده سیستم ایمنی را تولید می کنند که نتیجتا این انحراف در سیستم ایمنی موجب ایجاد MS میشود. شایان ذکر است، اثربخشی اکسیژن درمانی هیپرباریک (HBOT) برای درمان برخی از اختلالات عصبی، از جمله آسیب نخاعی ، آسیب مغزی، بیماری های عصبی ازجمله ام اس، برای چندین دهه گزارش شده است. علاوه بر این، به طور فزاینده ای مشهود است که HBOT به طور قابل توجهی پاسخ های ضد التهابی، آنژیوژنز در برابر هیپوکسی و توانایی فعالیت های ضد آپوپتوز را ارتقا می دهد و در نهایت نقش محافظتی در پیشرفت بیماری عصبی را نیز افزایش می دهد. همانطور که در این مطالعه گزارش شده است، بیماران ام اس به طور متناوب یا متوالی اکسیژن خالص را در محفظه اکسیژن هیپرباریک با فشار داخلی بیش از ۱ اتمسفر مطلق (ATA)، معمولاً ۱.۷۵ تا ۲.۵ ATA، به مدت یک ساعت یا بیشتر یک بار در روز طی چهار هفته درمان دریافت کردند. با این حال، چندین کارآزمایی بالینی محدود توصیه کردند که HBOT برای درمان ام اس در دهه های گذشته بی اثر بوده است. با این حال، برخی گزارشها مبنی بر استفاده از HBOT به عنوان مکمل درمان وجود دارد که نتیجه بهبودی بیشتری را در بیماران اماس مشاهده کرده اند. در نتیجه، نقش تعدیلی HBOT در درمان MS هنوز بحث برانگیز است. همانطور که مشخص است، سلول های T یک عامل ایمنی در شروع و پیشرفت ام اس هستند. با این حال، مشخص نیست که آیا نقش محافظتی HBOT را میتوان به مدولاسیون سلول T نسبت داد ؟ و اینکه چگونه HBOT سلولهای T خودواکنشی را در ضایعات CNS بیماران MS تعدیل میکند؟ برای بررسی اینکه آیا HBOT پاسخهای سلول T آغازگر بیماری ام اس را تعدیل میکند یا خیر، ما از آنسفالومیلیت خودایمنی تجربی (EAE) برای رمزگشایی بیشتر مکانیسمهای زمینهای استفاده کردیم. EAE یک مدل حیوانی برای بررسی MS و یک مدل مفید برای ارزیابی اثربخشی این مداخله درمانی است. EAE در انسان تظاهرات MS را تقلید میکند. هر دو سلول Th1 و Th17 که به ترتیب به عنوان سلولهای کمکی CD4 T تولیدکننده IFN و IL-17A نیز شناخته میشوند، در شروع و پیشرفت EAE نقش دارند. همانطور که مشخص است، سلولهای Th1 سیتوکینهای IFN- y و TNF-a را برای پیشرفت التهاب CNS EAE تولید میکنند اما با این حال، موشهای فاقد IFN- در برابر EAE محافظت نشدند، اما پیشرفت و همچنین شدت بیماری خودایمنی در آنها محدود شد. در مقابل، سلولهای Th17 سیتوکین IL-17a ترشح میکنند و نقش اساسی را در اوایل شروع بیماری EAE ایفا میکنند. کمبود سلول های Th17 شدت و بروز EAE را به شدت کاهش می دهد. علاوه بر این، سلولهای Th17 دارای انعطافپذیری خیرهکننده ای هستند و تبدیل به یک فنوتیپی از Th1 میشوند که IFN- و IL-17A-double ترشح کرده و سلولهای CD4 T (Th17 سابق) را تولید میکنند که نقش حیاتی در پاتوژنز EAE دارند. همانطور که بررسی شد، GM-CSF نیز توسط سلولهای Th1 و Th17 تولید میشود، با این حال، عمدتاً توسط سلولهای Th17 ترشح میشود تا یک سیتوکین انسفالیتوژنیک در ضایعه CNS EAE باشد. در همین حال، GM-CSF در یک زیرمجموعه جدید CD4 T غیر از Th1 و همچنین Th17 بیان میشود که قویا با شدت بیماری EAE مرتبط است. شایان ذکر است، CXCR4 یک گیرنده کموکاینی است که یک سلول T Helper را تعریف می کند که این گیرنده در ضایعه CNS EAE بسیار غنی شده است.
با این حال، هنوز مشخص نیست که آیا درمان HBOT نتایج بالینی آنسفالومیلیت خودایمنی را بهبود می بخشد یا خیر. برای آزمایش اینکه آیا HBOT یک درمان واقعی اصلاح کننده بیماری برای تعدیل فنوتیپ های سلول T CD4 است یا خیر ، ما از یک مدل موش EAE ایمن شده با گلیکوپروتئین ۳۵-۵۵ میلین در الیگودندروسیت در غیاب و در حضور HBOT استفاده کردیم، و در نهایت آن ها را ارزیابی کردیم که نشان داده شد که درمان با HBOT ، پیشرفت بیماری و شدت بالینی EAE ایمنشده با MOG را در موش کاهش میدهد. همچنین HBOT توسعه سلول T را در حضور سیگنالدهی TCR یا تحریک اتوآنتیژن سرکوب کرد. نکته قابل توجه این است که HBOT تعدد Th17 انسفالیتوژنیک را در ضایعات CNS موشهای EAE کاهش داد و میانگین تولید IFN-a و IL-17a را به ترتیب در سلولهای Th1 و Th17 کاهش داد. علاوه بر این، ما دریافتیم که HBOT به طور قابل توجهی تولید TNF-a و GM-CSF را در سلول های Helper CD4 T در ضایعه CNS کاهش می دهد. در مقابل، ما دریافتیم که HBOT به طور قابل توجهی میزان IL-4 و IL-10 سلول های Helper CD4 T را در CNS موش های EAE افزایش داد. در نهایت، HBOT انسفالومیلیتوژنسیته سلولهای کمکی T در CNS را تعدیل کرد، و در نهایت از این طریق باعث کاهش تظاهرات بالینی EAE شد.
مواد و روشها
حیوانات و طراحی تجربی
پروتکل استفاده از حیوانات (IACUC-107087) توسط کمیته مراقبت و استفاده از حیوانات دانشگاه پزشکی Kaohsiung تأیید شد. موش های ماده ۸ تا ۱۰ هفته ای از مرکز حیوانات آزمایشگاهی ملی (شهر تایپه، تایوان) خریداری شدند. این موشها در دمای ۲۱ درجه سانتیگراد، رطوبت ۵۵ تا ۷۰ درصد و به صورت ۱۲ ساعت در تاریکی و ۱۲ ساعت در روشنایی نگهداری میشوند. پس از ۲ هفته سازگاری، موش ها به طور تصادفی به دو گروه درمان با HBOT و همچنین گروه کنترل تقسیم شدند و با آنتی ژن MOG برای القای آنسفالومیلیت خودایمنی ایمن شدند. برای بررسی اثر HBOT بر تظاهرات بالینی EAE، موشهای ایمنسازی شده در مجموع ۴ هفته پس از ایمنسازی با MOG پیگیری شدند تا میزان بروز بیماری EAE، روز شروع بیماری، حداکثر امتیاز بالینی و مرحله اوج با حداکثر امتیاز بالینی تعیین شود. برای جمعیت سلول های ایمنی، سنجش تکثیر و ترشح سیتوکین، هر دو گروه موش در روز ۱۴ پس از ایمن سازی با MOG قربانی شدند و طحال، نخاع و مغز آنها تشریح و برداشت شد تا سوسپانسیون های تک سلولی از طحال و اینفیلتریشن سلول های تک هسته ای پارانشیمی CNS برای تجزیه و تحلیل بیشتر آماده شوند.
ایجاد EAE و ارزیابی تظاهرات بالینی
برای ایجاد مدل حیوانی بیماری EAE، موشهای ۱۰ تا ۱۲ هفتهای C57BL/6J با ۱۰۰ گرم پپتید MOG35-55 (خلوص ۹۸٪، MB Co., LTD.، شهر تایپه، تایوان) به طور کامل واکسینه شدند. پس از ایمن سازی با MOG، آن موش ها با هر واکسن ۲۵۰ نانوگرم سم سیاه سرفه (List Biological Laboratories, Campbell City, CA, USA) و در مجموع دو واکسن در روزهای ۰ و ۲ به صورت تزریق داخل صفاقی دریافت کردند . با ایجاد EAE ، علائم فلج دم و اندام تظاهر میابد و این تظاهرات بالینی بالینی یک بار در روز در صبح با تخصیص نمرات ۰ تا ۵ به شرح زیر ارزیابی شد: ۰، بدون علامت بالینی. ۰.۵، ضعف جزئی دم اندام؛ ۱، فلج کامل دم. ۲، فلج یک اندام عقبی. ۳، فلج هر دو اندام عقبی. ۴، فلج اندام جلویی. ۵، در حال مرگ یا مرگ.
اکسیژن درمانی هیپرباریک (HBOT)
برای ارزیابی اثرات درمانی HBOT در بیماری EAE، در گروه HBOT، موشهای EAE در یک اتاقک اکسیژن هیپرباریک (Genmall Biotech Co. LTD.، شهر تایپه، تایوان) یک بار در روز به مدت پنج روز متوالی از روز ۸ تا ۱۲ پس از ایمن سازی با MOG، و به دنبال آن دو روز استراحت ، مورد اکسیژن تراپی قرار گرفتند. موشهای EAE دور دوم HBOT را یک بار در روز برای پنج روز متوالی دیگر از روز ۱۵ تا ۱۹ دریافت کردند که در مجموع ده بار HBOT برای هر موش میشد. فشار داخلی محفظه اکسیژن هیپرباریک به تدریج از ۱ به ۲.۵ ATA طی ۲۰ دقیقه افزایش یافت و سپس فشار در مجموع یک ساعت در ۲.۵ ATA حفظ شد. موش های EAE فوق الذکر در آن محفظه با یک صفحه پارتیشن قرار گرفتند تا از ازدحام نزدیک آنها جلوگیری شود و بتوانند آزادانه نفس بکشند تا از تأثیرگذاری بر یکدیگر جلوگیری کنند. پس از یک ساعت HBOT، فشار داخلی محفظه به تدریج از ۲.۵ ATA به فشار اکسیژن معمولی اتاق طی ۲۰ دقیقه کاهش یافت. در گروه کنترل موشهای EAE در قفس تحت فشار معمولی اکسیژن اتاق قرار گرفتند.
آماده سازی بافت
برای تجزیه و تحلیل مکانیسمهای HBOT در زیر مجموعههای سلول T، موشها به واسطه CO2 در روز ۱۴ ایمنسازی MOG برای جداسازی سلولهای تک هستهای پارانشیمی CNS برای آنالیز فلوسایتومتری قربانی شدند. بافتهای CNS به صورت مکانیکی از طریق صافی مش ۱۰۰ میکرومتری (BD Falcon, San Jose City, CA, USA) جدا شدند و سوسپانسیونهای تک سلولی همگن شده متعاقباً بر روی یک گرادیان پرکول ۷۰-۳۰٪ با سانتریفیوژ ۵۰۰ تقسیم شدند. سلولهای تک هستهای پارانشیمی از فاز مشترک جمعآوری شدند و سپس دو بار با ۱ بافر HBSS (محلول نمک متعادل Hank) بدون فنل قرمز شسته شدند. در نتیجه، سلولهای تک هستهای شمارش و سپس با ۱ کوکتل تحریک سلولی (بهعلاوه مهارکنندههای انتقال پروتئین) (eBiosciences، شهر سن دیگو، CA، ایالات متحده آمریکا) به مدت ۴ ساعت در دمای ۳۷ درجه سانتیگراد در ۵ درصد رطوبت در انکوباتور تحریک شدند. سلول های تک هسته ای تحریک شده با کوکتل تحت فرآیند رنگ آمیزی داخل سلولی قرار گرفتند و داده های فلوسایتومتری توسط سیتومتر BD LSRII جمع آوری شد. برای تجزیه و تحلیل بافت شناسی، طناب نخاعی سینه ای پس از پرفیوژن PBS جدا شد و بلافاصله توسط فرمالدئید ۴ درصد (فرمالین ۱۰ درصد) به مدت دو روز تثبیت شد و برای تهیه برش بافت در پارافین جاسازی شد.
نتایج
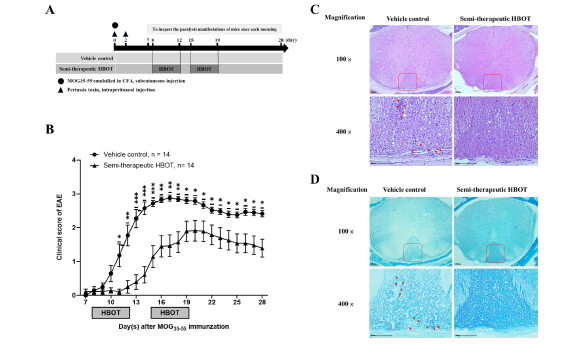
۳.۱. Hbot پیشرفت بیماری و شدت آنسفالومیلیت خودایمنی را بهبود می بخشد و همچنین لکوسیت های تک هسته ای پارانشیمی و دمیلیناسیون را کاهش می دهد.
برای بررسی اینکه آیا اکسیژن هیپرباریک پاسخ ایمنی تطبیقی را تعدیل میکند، ما از مدل حیوانی EAE در غیاب و حضور HBOT برای بررسی بیشتر بروز بیماری، پیشرفت و شدت تظاهرات بالینی استفاده کردیم. ما از پپتیدهای آنتی ژنی MOG35-55 امولسیون شده در حضور CFA کامل همراه با ۴ میلی گرم در میلی لیتر مایکوباکتریوم توبرکلوزیس از طریق زیر جلدی و همچنین دو تزریق سموم سیاه سرفه از طریق داخل صفاقی استفاده کردیم . پس از ایمنسازی MOG، موشها یک روز قبل از میانگین روز شروع بیماری (معمولاً روز ۹ پس از ایمنسازی MOG/CFA در آزمایشگاه ما) در محفظه اکسیژن هیپرباریک قرار گرفتند تا علائم فلج دم را دچار شوند. در گروه HBOT، موشهای ایمنشده با MOG یک بار در روز به مدت پنج روز متوالی (از روز ۸ تا ۱۲) با استفاده از یک اتاقک اکسیژن هیپرباریک و سپس دو روز برای استراحت ، HBOT دریافت کردند. متعاقباً، آن موشها مجدداً یک بار در روز به مدت پنج روز متوالی (از روز ۱۵ تا ۱۹) HBOT دریافت کردند و در نهایت در مجموع ده بار درمان برای هر موش انجام شد. موش ها در محفظه اکسیژن هایپرباریک با فشار داخلی ۲.۵ ATA به مدت یک ساعت در روز قرار گرفتند. نتایج ما نشان داد که، در گروه کنترل ، موشهای C57BL/6J با ۱۰۰ گرم MOG35-55/CFA در روز صفر و به دنبال آن دو تزریق سم سیاه سرفه در روز ۰ و ۲ واکسینه شدند، که با فلج جزئی دم در روز. ۸ پس از ایمن سازی با MOG شروع شد و رسیدن به حداکثر امتیاز بالینی در روز ۱۶ (شکل ۱B) رخ داد. با این حال، ما دریافتیم که در گروه HBOT به ترتیب پیشرفت بیماری و شدت EAE در مقایسه با گروه کنترل به طور قابل توجهی کاهش یافت (شکل ۱B). بروز EAE موش های تحت درمان با HBOT کمی کمتر از موش های کنترل بود (۸۶٪ در مقابل ۱۰۰٪) (جدول ۱). علاوه بر این، HBOT به ندرت شروع EAE را در موش ها پس از ایمن سازی با MOG در مقایسه با موش های کنترل EAE (12.3 در مقابل ۱۰.۶ ۰.۵) به تاخیر انداخت (جدول ۱). حداکثر نمرات بالینی موش های EAE در گروه HBOT در مقایسه با گروه کنترل به طرز چشمگیری کاهش یافت (۲.۲ ۰.۳ در مقابل ۳.۱ ۰.۱) (جدول ۱). پس از آن، برای بررسی تجزیه و تحلیل بافت شناسی، یک برش عرضی بافتی از نخاع قفسه سینه ای از موش های EAE قربانی در غیاب و حضور HBOT در روز ۱۴ پس از ایمن سازی با MOG تهیه شد. با رنگ آمیزی H&E، ما دریافتیم که تعداد بسیار کمتری از لکوسیت های تک هسته ای در ماده سفید پارانشیمی نخاع موش های EAE تحت درمان با HBOT نسبت به موش های کنترل دیده میشود (شکل ۱C). تشکیل حباب واکوئل مانند در طناب نخاعی قفسه سینه ای در موش های EAE کنترل در مقایسه با موش های تحت درمان با HBOT افزایش یافت (شکل ۱C). علاوه بر این، با رنگآمیزی LFB، علائم دمیلیناسیون ماده سفید پارانشیم نخاع قفسهای در موشهای EAE کنترل از موشهای تحت درمان با HBOT بیشتر بود (شکل ۱D).
در نهایت، نتایج ما نشان داد که HBOT آنسفالومیلیت خودایمنی را بهبود بخشیده و تظاهرات EAE را کاهش داده و نهایتا میتوان این متد درمانی را به عنوان یک متد موثر در برابر بیماری های خود ایمنی به کار گرفت.

۳.۲. HBOT پاسخ های التهابی Th1 و Th17 را در ضایعات CNS انسفالومیلیت خودایمنی تسکین می دهد.
برای بررسی اینکه آیا HBOT بر پاسخهای التهابی سلولهای T خودواکنشی تأثیر میگذارد یا خیر، با آنالیز فلوسایتومتری، سلولهای CD4 T تولیدکننده سیتوکینهای التهابی را در CNS موشهای EAE تحت درمان با HBOT بررسی کردیم. تعداد کل سلول های تک هسته ای پارانشیمی و زیر مجموعه سلول های CD4 T (CD45hi/CD3″+/CD4+) در ضایعات CNS موش EAE اندازه گیری شد.نتایج ما نشان داد که تعداد کل سلول های تک هسته ای و زیر مجموعه سلول های T CD4 به طور قابل توجهی در ضایعات CNS موشهای EAE تحت درمان با HBOT در مقایسه با موشهای کنترل کاهش یافته است (شکل ۳A). بر این اساس، نتایج ما نشان داد که درصد سلول های CD4 T تولید کننده IL-17A در CNS موش های EAE دریافت کننده HBOT به طور قابل توجهی کمتر از موش های کنترل بود (شکل ۳، C). در نتیجه، ما متوجه شدیم که تعداد سلولهای در ضایعات CNS موشهای EAE تحت درمان با HBOT در مقایسه با موشهای EAE کنترل بهطور چشمگیری کاهش یافته است (شکل ۳D). ما دریافتیم که IFN- aو IL-17A به طور قابل توجهی در سلولهای Th1 و Th17 موشهای EAE که HBOT دریافت میکنند در مقایسه با گروه کنترل کاهش یافته است (شکل ۳E).
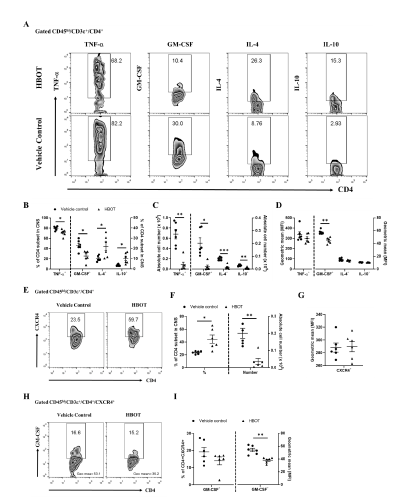
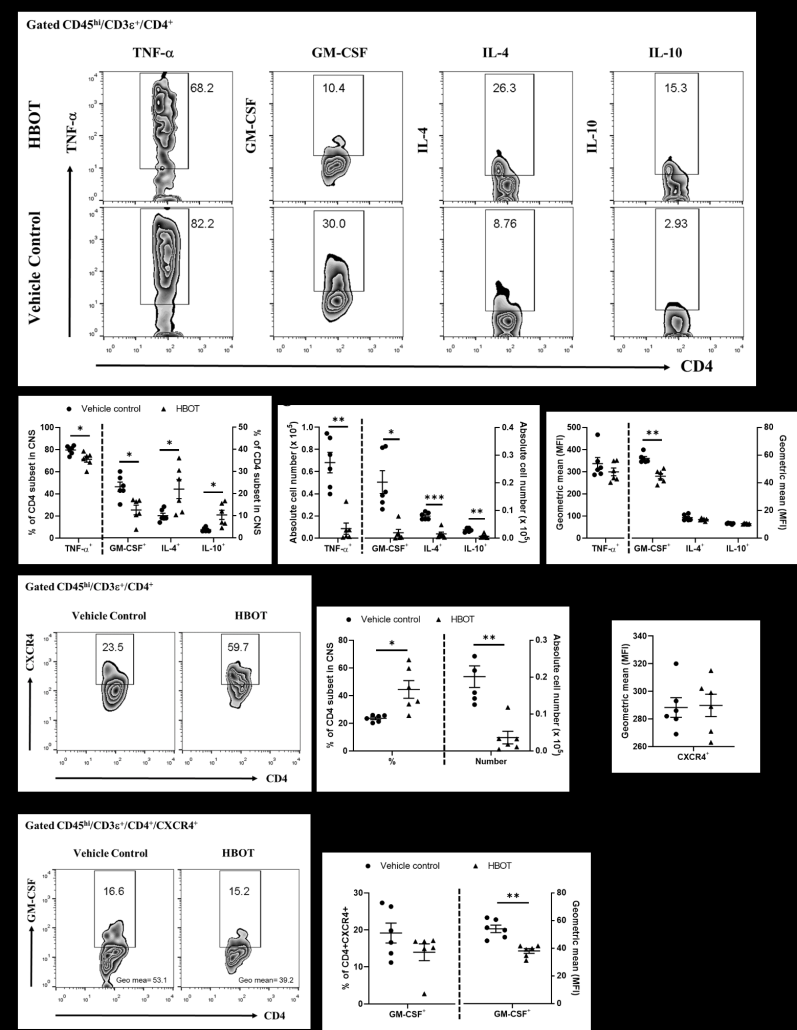
۳.۳. HBOT تولید TNF-a و GM-CSF را در زیر مجموعه های سلول های CD4 T کاهش داده و تولید IL4 و IL10 را در ضایعات CNS انسفالومیلیت خودایمنی افزایش می دهد.
نتایج ما نشان داد که تعداد سلول های تولید کننده TNF-a و GM-CSF در زیر مجموعه های سلول T CD4 موشهای EAE تحت درمان با HBOT در مقایسه با موشهای EAE کنترل بهطور قابلتوجهی کاهش یافتند (شکل ۴B، C، پانل سمت چپ).(شکل ۴D، پانل سمت چپ). این نتایج نشان میدهد که HBOT عمیقاً پاسخهای پیشالتهابی ناشی از تولید TNF-a و GM-CSF در سلولهای CD4 T خود واکنشی در ضایعات CNS را تضعیف میکند. ما علاوه بر این تولید IL-4 و IL-10 را در زیر مجموعه سلول های T CD4 ضایعات CNS از موش های EAE در روز ۱۴ پس از ایمن سازی با MOG آزمایش کردیم. نتایج ما نشان داد که تعدد زیرمجموعههای سلولهای CD4 T ترشحکننده IL-4- و IL-10 در ضایعات CNS موشهای EAE تحت درمان با HBOT در مقایسه با موشهای EAE کنترل به طور قابلتوجهی افزایش یافته است (شکل ۴B, پنل سمت راست). در نتیجه، این نتایج نشان میدهد که HBOT به ترتیب تولید سیتوکینهای سرکوبکننده سیستم ایمنی مثل IL-4 و IL-10 سلولهای CD4 T را در ضایعات CNS ارتقا میدهد، بنابراین حداقل به تضعیف تظاهرات بالینی EAE کمک میکند. همانطور که گزارش شده است، CXCR4 یک گیرنده کموکاینی قوی سلول های T آنسفالومیلیتوژن در ایجاد آنسفالومیلیت خودایمنی است. داده های ما نشان داد که تعداد سلول های CD4 T انسفالومیلیتوژنیک بیان کننده CXCR4 در ضایعات CNS در موش های EAE تحت درمان با HBOT بسیار کمتر از موش های بدون درمان بود و به طور کلی میتوان گفت که HBOT به طور قابل توجهی بیماری زایی سلول های CD4 T انسفالومیلیتوژن بیان کننده CXCR4 را از طریق کاهش GM-CSF ، تخفیف داد.
بحث
نتایج ما نشان داد که HBOT شدت بالینی و پیشرفت EAE ایمن شده با MOG را کاهش می دهد. ما موش های EAE را با HBOT از روز ۸ پس از ایمن سازی با MOG درمان کردیم و میانگین شروع بیماری در آزمایشگاه ما ۱۰.۴ روز بود. به طور منطقی، ما پیشنهاد کردیم که برای درمان موثر به واسطه HBOT لازم است که آن را در یک نقطه زمانی زودتر در نزدیکی شروع بیماری، قبل یا کمی بعد از شروع، آغاز کنیم. علاوه بر این، شواهد ما تا حدی یک پایه علمی به آن مطالعاتی که نقش محافظتی HBOT در بیماران ام اس یا سلول های عصبی را بررسی می کنند، اضافه می کند. در سال ۱۹۸۳، فیشر و همکارانش بیماران ام اس را برای کارآزمایی درمان HBOT ثبت نام کردند و پاسخ اولیه مثبتی را برای بیماران ام اس پیدا کردند. با این وجود، آنها همچنان ترجیح نمیدهند که درمان HBOT را برای اماس توصیه کنند، مگر اینکه تأیید بیشتری در مورد پیگیری های طولانیمدت اخذ شود. اخیراً HBOT برای بیماران ام اس به کار گرفته شد و از نقش محافظتی HBOT در علائم بیماری پشتیبانی کرد. مکانیسمهای اساسی مربوط به ICAM-1 سلولهای اندوتلیال، حفظ نفوذپذیری سد خونی مغزی (BBB) یا هموستاز استرس ER در سلولهای عصبی، در نهایت، تا حدی به نقش محافظتی HBOT کمک میکند. در بالا. با این حال، چندین آزمایش بالینی قبلی قبل از سال ۲۰۱۰ نشان داد که HBOT برای درمان MS توصیه نمی شود. این کارآزماییها بیماران اماس را که درمان HBOT را به عنوان مکمل درمان دریافت کرده بودند، ثبت کردند. مزایای درمانی کلی بیماران ام اس تحت درمان با HBOT تفاوت قابل توجهی با بیماران کنترل دارونما نداشت. این کارآزماییها برای استفاده از فشارهای مختلفی از اکسیژن هیپرباریک ، فرکانس جلسات و زمان درمان به صورت فردی انجام شدند. علاوه بر این، گروههای کنترل دارونما در بین آن کارآزماییها به طور متفاوتی تعریف شدند و ارزیابی علائم بالینی به طور مساوی ثبت نشد و طبق قوانین استاندارد مشابه تجزیه و تحلیل نشد. مهمتر از همه، در آن کارآزماییهای بالینی، بیماران MS ، HBOT را در مراحل بعدی بیماری دریافت کردند، در حالی که تظاهرات بالینی آنها بدتر شده بود. در مقابل، نتایج ما تأکید کرد که HBOT بیماری EAE را بهبود میبخشد که البته موشها HBOT را در مراحل بسیار زودتر قبل از مرحله مؤثر بیماری دریافت میکردند، و این مساله تا حدی توضیح میدهد که چرا آن دسته از بیماران MS که در مراحل بعدی در آزمایشهای بالینی قبلی قرار داشتند، از مزایای این متد درمانی بهرهمند نشدند. ما دو مرحله از پنج درمان متوالی HBOT را در موشهای EAE اجرا کردیم و سلولهای T در ضایعات CNS در روز ۱۴ پس از ایمنسازی با MOG مورد بررسی قرار گرفت. گزارشهای دیگر همچنین از نتایج ما در مورد آسیب نخاعی و آسیب مغزی تروماتیک پشتیبانی میکنند، که زمان مداخله با HBOT در مراحل اولیه اثربخشی درمانی را به شدت تعیین میکرد. در این مطالعه، درمان HBOT پاسخ ضد التهابی را ارتقا داد و همچنین شدت بیماری EAE را با کاهش نفوذ سلول های تک هستهای پارانشیمی کاهش داد. علاوه بر این، ما دریافتیم که HBOT سیتوکین های التهابی را کاهش می دهد و سیتوکین های سرکوب کننده سیستم ایمنی حاصل از سلول های CD4 T را افزایش می دهد. یافته های ما تا حدودی توسط گزارش های قبلی نیز تایید شد. امروزه، HBOT معمولاً برای درمان اختلالات عصبی، که با اثرات ضد التهابی در برابر پیشرفت بیماری آشکار می شود، استفاده می شود. یکی از مکانیسمهای اساسی HBOT به تعدیل سیتوکینها، افزایش سیتوکین سرکوبکننده سیستم ایمنی و همچنین به تاخیر انداختن سایتوکاینهای پیشالتهابی نسبت داده میشود. در آسیب نخاعی ، درمان HBOT تولید IL-10 و VEGF را افزایش داد و همچنین تولید بیش از حد IL-1 و a-TNF را کاهش داد.
در مدل آسیب مغزی تروماتیک، HBOT تولید سرکوب کننده سیستم ایمنی IL-10 را برای توسعه اثرات ضد التهابی افزایش داد. HBOT تولید IL-4 و IL-13 را برای اعمال اثرات ضد التهابی در آسیب نخاعی و بیماریهای عصبی افزایش داد. HBOT التهاب را کاهش داد و منجر به کاهش IL-1 و همچنین IL-18 و مسیرهای سیگنال دهی مرتبط با آن شد که نشان دهنده اثر مهاری HBOT بر زمینه التهاب است. مطابق با آن گزارشهای قبلی، یافتههای ما علاوه بر این، پایهای علمی برای حمایت از HBOT فراهم کرد که این روش درمانی، تولیدات IL-17a، TNF-a و GM-CSF با منشا سلولهای CD4 T از ضایعات CNS موشهای EAE را کاهش میدهد. با این حال، HBOT بیان IL-4 و IL-10 سلول های CD4 T را از ضایعات CNS افزایش داد. از سوی دیگر، مکانیسم نقش محافظتی HBOT به حفظ یکپارچگی BBB نسبت داده می شود که منجر به کاهش نفوذ لکوسیت تک هسته ای به CNS می شود. در آسیب مغزی تروماتیک، HBOT برای کاهش اختلال BBB و کاهش نفوذپذیری آن ثابت شده است. در MS، HBOT به طور قابل توجهی بیان ICAM-1 سلولهای اندوتلیال مغز را کاهش داد، که بر مهار مهاجرت سلولهای التهابی از طریق سد خونی مغزی (BBB) دلالت دارد. علاوه بر این، سلولهای Th1 و Th17 به ترتیب IFN-y و IL-17A را تولید میکنند تا BBB را در مراحل اولیه MS و EAE مختل کنند. به طور مشابه، GM-CSF BBB را تجزیه می کند و مهاجرت مونوسیت ها را از طریق BBB به CNS ترویج می کند. مطابق با گزارشهای قبلی، ما دریافتیم که تعداد لکوسیتهای تک هستهای در موشهای EAE تحت درمان با HBOT بسیار کمتر از موشهای EAE کنترل بود که این مساله تا حدی از نقش بازدارنده HBOT در مهاجرت سلول های تک هسته ای به CNS حمایت میکند. همچنین ما دریافتیم که HBOT سلولهای Th17 و سلولهای CD4 T تولیدکننده GM-CSF را در ضایعات CNS EAE کاهش میدهد. احتمالاً HBOT سلولهای Th17 و تولید GM-CSF توسط CD4 T را کاهش میدهد و سپس یکپارچگی BBB را ارتقا میدهد و متعاقباً از ورود لکوسیتها به CNS جلوگیری میکند. ثابت شده است که HBOT بیان HIF-1a را با افزایش اکسیژن در ضایعات CNS در اختلالات عصبی سرکوب می کند و از طریق تولید VEGF باعث تقویت رگ زایی می شود. HIF-1 توسط شرایط هیپوکسی برای تنظیم رشد سلول های Th17 در طول پاتوژنز EAE القا شد. مطابق با نتایج ما، HBOT پاسخ سلول Th17 را در ضایعات CNS EAE کاهش داد.
در این مطالعه، ما دریافتیم که HBOT بر فرکانس Th17 تأثیر می گذارد، اما نه Th1 و همچنین سلول های Th17 سابق.
مطابق با مطالعات قبلی، سلول Th17 جمعیت T انسفالیتوژنیک اصلی در EAE را تشکیل میدهد و نقش IL-17A مترشحه از این سلول ها در ایجاد التهاب عصبی در آنسفالومیلیت خودایمنی به سزا است. در نتیجه، ما این مساله را مطرح کردیم که تضعیف EAE به واسطه HBOT، حداقل تا حدی با کاهش تمایز Th17 در ضایعات CNS مرتبط است. علاوه بر این، دادههای ما همچنین نشان داد که زیرمجموعههای سلولهای CD4 T تولیدکننده GM-CSF و TNF-a در موشهای EAE تحت درمان با HBOT سرکوب شدند. مطابق با مطالعات قبلی، موشهای دارای کمبود GM-CSF به القای EAE مقاوم هستند. یک زیرمجموعه سلولی کمکی CD4 T جدید، که GM-CSF و CXCR4 را بیان میکرد، قبلاً در MS تعریف شده بود و نقش انسفالیتوژنیک در پیشرفت بیماری داشت. از سوی دیگر نقش HBOT برای ترویج SDF-1/CXCR4 در آسیب نخاعی مشهود بود. علاوه بر این، TNF با IL-17A و GM-CSF برای افزایش مهاجرت نوتروفیل ها و مونوسیت ها همکاری می کند و کمبود آن باعث کاهش EAE در موش می شود. این گزارشهای قبلی بیشتر از نتایج ما حمایت کردند که زمینه التهابی به طور قابلتوجهی در ضایعات CNS موشهای EAE تحت درمان با HBOT کاهش مییابد، و یک مبنای علمی برای روشن کردن یک اثر محافظتی HBOT در EAE ارائه میدهد.
نتیجه گیری ها
در این مطالعه، ما نشان دادیم که HBOT تظاهرات بالینی و پیشرفت EAE ایمنشده با MOG را کاهش میدهد که در آن موشها در مراحل اولیه قبل از مرحله مؤثر بیماری، درمان را دریافت کردند. HBOT به طور قابلتوجهی فرکانس سلولهای Th17 را کاهش داد، اما تاثیری بر Th1 موجود در ضایعات CNS موشهای EAE نداشته است. ما متوجه شدیم که تعداد سلولهای زیرمجموعههای سلول T در موشهای EAE تحت درمان با HBOT به طور قابلتوجهی کاهش یافته است. مشخص شد که بیان IFN-y و IL-17A به ترتیب در سلولهای Th1 و Th17 موشهای EAE که به CNS نفوذ میکنند در حضور HBOT کاهش یافت. علاوه بر این، ما دریافتیم که تولید TNF و GM-CSF در زیرمجموعه سلولهای T CD4 در ضایعات CNS موشهای EAE تحت درمان با HBOT بهطور چشمگیری به تعویق افتاده است. علاوه بر این، IL-4 و IL-10 عمیقاً در زیرمجموعه های سلول های CD4 T در ضایعات CNS موش های EAE به واسطه HBOT تقویت شدند. در نهایت، نتایج ما نشان داد که HBOT برای درمان EAE ایمنشده با MOG از طریق مدولاسیون زیر مجموعههای سلول T موثر است.