چکیده آنسفالومیلیت میالژیک:
(۱) زمینه: آنسفالومیلیت میالژیک/سندرم خستگی مزمن یک سندرم شدید است که خستگی اصلی ترین و برجسته ترین علامت آن هست. شواهد قبلی از توانایی اوزون برای تسکین خستگی ناشی از سندروم خستگی مزمن و آنسفالومیلیت میالژیک در بیماران مبتلا حمایت کرده است.
- روشها: ۲۰۰ بیمار مبتلا به سندروم خستگی مزمن و آنسفالومیلیت میالژیک که از قبل مشخص شده بودند(میانگین سنی ۳۳ تا ۱۳ سال) با روش رابینر ( سالین DIV ) اکسیژن-اوزون تحت درمان قرار گرفتند (O۲-O۳-AHT). خستگی از طریق پرسشنامه ۷ امتیازی مقیاس شدت خستگی، ۳۰ روز قبل و بعد از درمان ارزیابی شد.
- نتایج: تقریبا نیمی (۴۳.۵٪) از بیماران تحت درمان، مقیاس شدت خستگی خود را از یک به ۷ رساندند، این به معنای بالاترین پیشرفت از درمان با O۲-O۳-AHT است. بعلاوه، ۷۷.۵٪ از بیماران بهبود نسبی از ۴ به ۶ را تجربه کردند. هیچ بیمار عوارض جانبی نشان نداد و پس از سه ماه از گذشت درمان خستگی از بین رفت.
- نتیجه گیری: درمان با O۲-O۳-AHT تا حد زیادی خستگی ناشی از سندروم خستگی مزمن وآنسفالومیلیت میالژیک را جدای از تفاوت های جنسی و سنی بهبود می بخشد.
کلید واژه ها: سندروم خستگی مزمن؛ اوزون؛ اکسیژن-اوزون درمانی؛ خستگی؛ کارازمایی بالینی

مقدمه
آنسفالومیلیت میالژیک/سندرم خستگی مزمن و آنسفالومیلیت میالژیک، که اخیراً آزمایشات زیادی راجع به آن انجام شده است، یک اصطلاح پیچیده برای شناسایی یک بیماری چند سیستمی، جدی و طولانی مدت است که با خستگی و درد اسکلتی- عضلانی ناتوان کننده مشخص می شود که معمولاً بیماران را به طور ناگهانی مجبور به توقف فعالیت های روزمره می کند. خستگی علامتی است که در سندروم خستگی مزمن بسیار مهم است و معمولاً برای آزمایش توسعه عمومی علائم سندروم خستگی مزمن بر اساس یک درمان تعریف شده استفاده می شود. اپیدمیولوژی سندروم خستگی مزمن به طور گسترده بررسی شده است. تحقیقات قبلی که در ایتالیا به عنوان رویکردهای پیشرو در درمان خستگی انجام شده بود به دهه نود برمی گردد. در ایتالیا، تحقیق اخیری که بر روی ۸۲ بیمار سندروم خستگی مزمن ساکن مناطق شمالی کشور انجام شد، میانگین سنی ۳۲ سال بود، تقریباً نیمی از این بیماران علائم اولیه را بین ۲۴ تا ۴۰ سال نشان دادند و علائم شایع سندروم خستگی مزمن (۳:۱) در زنان مشاهده شد. با این حال، ارزیابی صحیح شیوع سندروم خستگی مزمن یک کار سنگین است، زیرا تشخیص سندروم خستگی مزمن دشوار است و اغلب بیماران با خستگی و سایر علائم بالینی دیگر بیماریهای مزمن اشتباه گرفته می شوند. معیارهای تشخیصی اخیر برای سندروم خستگی مزمن از مراکز کنترل و پیشگیری از بیماری، به اصطلاح معیارهای تشخیصی سال ۲۰۱۵ سازمان ملی مهاجران، که دستورالعمل سال ۱۹۹۴ مرکز کنترل و پیشگیری از بیماری را به روز کرد، شامل علائم و نشانه هایی مانند خستگی شدید و مزمن است که معمولاً بیش از شش ماه طول می کشد، و همچنین وجود حداقل چهار مورد از علائم فیزیکی: خواب ناخوشایند، اختلال در تمرکز، توجه یا حافظه، ضعف پس از تمرین، سردرد، درد عضلانی-اسکلتی و پل آرترالژی، غدد لنفاوی حساس و گلودرد. بنابراین تشخیص سندروم خستگی مزمن کاملاً بر اساس شواهد بالینی است، جایی که خستگی طولانی مدت و ناتوان کننده نشان دهنده اصلی ترین و برجسته ترین علامت ها است.
مشکلات در راه رسیدن به یک ارزیابی تشخیصی صحیح و مناسب سندروم خستگی مزمن، به نوعی امکان یافتن یک درمان موثر برای سندروم خستگی مزمن و آنسفالومیلیت میالژیک را مختل می کند. حتی با تلاش های ستودنی گذشته گروه ما، سندروم خستگی مزمن همچنان یک بیماری پیچیده برای کلینیک ها باقی مانده است. افراد مبتلا به سندروم خستگی مزمن باید از نظر افسردگی، درد و حتی اختلالات خواب همزمان بررسی شوند. تا به امروز، تنها گزینههای درمانی موجود شامل نوعی درمان شناختی رفتاری، از جمله توانبخشی با ورزش حرکتی درجهبندیشده است، رویکردهایی که نشان داده شده است که فقط کمی خستگی را بهبود میبخشد و همچنین سازگاری اجتماعی، اضطراب و ضعف پس از تمرین را بهبود میبخشند. با این حال، هیچ درمان دارویی تا به امروز به طور کامل موثر ثابت نشده است.
تشویق تلاشها برای درمان خستگی سندروم و آنسفالومیلیت میالژیک خستگی مزمن با اوزون اکسیژن-اوزون (O۲-O۳-AHT) توسط گروه های ما و دیگران با موفقیت انجام شد. اکسیژن-اوزون درمانی قادر است بسیاری از جنبه های پیچیده ایمنی را تعدیل کند، که اکثریت آنها زمینه ساز مکانیسم های بیماری زایی ایجاد کننده سندروم خستگی مزمن هستند. جالب توجه است، همانطور که در کووید۱۹ رخ داد، جایی که O۲-O۳-AHT به ویژه در درمان استرس اکسیداتیو مرتبط با بیماری موثر است، سندروم خستگی مزمن و آنسفالومیلیت میالژیک نیز ممکن است یک پاتوژنز ایجاد کننده استرس اکسیداتیو داشته باشد. نتایج به دست آده نشان می دهد که اوزون التهاب را از بین بردن سیگنال های استرس اکسیداتیو تعدیل می کند و با نتایج تشویق کننده قبلی در سندروم خستگی مزمن، درمان خستگی در بیماران مبتلا به O۲-O۳-AHT را به ما پیشنهاد کرد. در این مقاله ما علائم خستگی را در گروه بزرگی از بیماران مبتلا به سندروم خستگی مزمن و آنسفالومیلیت میالژیک با اتخاذ O۲-O۳-AHT درمان کردیم. نتایج در اینجا شرح و بحث شده است.
مواد و روشهای درمان
جذب بیماران به انجام آزمایش
تعداد ۲۲۴ بیمار سرپایی که به طور کلی به مراکز بالینی مختلف پوردنونه و گورل (برگامو) مراجعه کرده بودند، بر اساس معیارهای واجد شرایط بودن ارزیابی شده برای تحقیق پژوهشی حاضر انتخاب شدند، ۲۰۰ نفر وارد تحقیق شدند، ۱۹ نفر طرح تحقیق را پیگیری نکردند و از تحقیق خارج شدند. ۵ نفر تحقیق پژوهشی را به طور رسمی پذیرفتند اما هرگز به دلایل شخصی متفاوت این فرآیند را آغاز نکردند. توزیع سنی میانگین ۳۳.۰۸ تا ۱۳.۵۰ سال گزارش شد [CI۹۵ = 31.۲۰-۳۴.۹۷] و میانه ۳۳.۱۴ سال، گروه از ۶۹ مرد (۳۴.۵٪) تشکیل شده بود، بنابراین اکثر بیماران را زنان تشکیل داده بودند. طبق توصیه های مقاله هلسینکی، همه بیماران به طور کامل از شیوه نامه درمانی و استفاده از داده ها برای اهداف تحقیقاتی مطلع شدند.
معیارهای به حساب آمده و به حساب نیامده
معیار هایی که در تحقیق به آن ها توجه می شود، برای بیمارانی که به کلینیک ما مراجعه کردند، به صورت دقیق توضیح داده شد. یک رضایت نامه در کمال آگاهی از آنان گرفته شد و اجازه به اشتراک گذاری داده های به دست آمده از تحقیق نیز از آنان گرفته شد. معیارهای خارج از تحقیق با بیمارانی با پاتولوژی های التهابی فعال مزمن یا اختلالات عصبی و روانپزشکی، مثبت بودن تست کرونا، تجربه کووید۱۹ در ۶ ماه گذشته، علائم سندروم پس از کووید، مصرف داروهای دارویی در دوره قبلی نشان داده شد. ۷۲ ساعت، با تشخیص اختلالات خودایمنی به غیر از سندروم خستگی مزمن و آنسفالومیلیت میالژیک، ابتلا به سرطان، اگر زنان باردار هستند.
اندازه نمونه
حجم نمونه برای دستیابی به محدوده خطا حدود ۱۰ درصد محاسبه شد. با اشاره به نسبت جمعیت ۵۱ درصد، دادههای پیشبینی منجر به خطای ۱۳.۸۶ درصدی با ۵۰ بیمار شد، در حالی که با ۱۰۳ بیمار خطای ۹.۸% مشاهده شد، در نتیجه با حدود ۲۰۰ بیمار ما کمترین میزان خطا را در این آزمایش داریم. آزمون دی کوهن برای دو گروه مجزا، یعنی قبل از O۲-O۳-AHT و به دنبال O۲-O۳-AHT موفقیت آمیز بود (p = 0.004323 یا مقدار g Hedges). علاوه بر این، دلتای شیشه ای p = 0.012444 (p <0.02).
ارزیابی بیماران از علائم خستگی
یک آزمایش ایمنی بدن و ویزیت کامل حدود ۴۰ تا ۶۰ دقیقه انجام شد. خستگی علامت اصلی ارزیابیشده در این تحقیق بود که به دلیل ویژگیهای عملکرد بهینه، پایداری در طول زمان و امکان ناچیز تحت الشعاع قرار گرفتن با سایر علائم جزئی، میتوانست وضعیت کلی بالینی بیمار را با معتبرترین و قابل اعتمادترین رویکرد برجسته کند. از هر بیمار خواسته شد تا قبل از انجام درمان و یک ماه پس از درمان، به مقیاس شدت خستگی سیستم ۷ امتیازی (مقیاس شدت خستگی) پاسخ دهد. نتایج به عنوان نمرات جمع آوری و مورد ارزیابی آماری قرار گرفت.
درمان سندروم خستگی با روش رابینر ( سالین DIV ) اوزون اکسیژن (O۲-O۳-AHT)
طبق پروتکلی که قبلاً توسط انجمن ایتالیایی اکسیژن-اوزون درمانی (SIOOT) ارزیابی شده بود، بیماران حداقل دو جلسه هفتگی تحت روش رابینر ( سالین DIV ) عمده اکسیژن-اوزون قرار گرفتند.۲۷]. برای هر جلسه O۲-O۳-AHT سی دقیقه وقت در نظر گرفته شد. بهبود به سرعت اتفاق نمی افتد، اما پس از یک هفته یا یک ماه طی کردن دوره درمانی به وضوح قابل مشاهده خواهد بود. بنابراین، نمی توان محاسبه کرد که اگر جلسات بیشتری انجام شود، پیشرفت بسیار بالاتر است. اوزون به صورت تجمعی عمل نمی کند، اما مکانیسم های ظریف و پیچیده ای را در بدن بیمار ایجاد می کند. حجم ۲۰۰ میلی لیتر خون از هر بیمار گرفته شد و در کیسه SANO3 دارای گواهی استاندارد جمع آوری شد، سپس بلافاصله با ۴۵ گرم در میلی لیتر اوزون در یک O۲-O۳ مخلوط، به طور مداوم توسط دستگاه ابزاری Multioxygen Medical 95 CPS تنظیم می شود. مولتی اکسیژن® پزشکی ۹۵ به عنوان یک واحد سرپایی برای O۲-O۳ درمان، به اپراتورها اجازه می دهد تا مخلوط گاز را مطابق با درخواست بالینی سفارشی کنند. در واقع، O۲-O۳ مولد مخلوط توسط یک ریزپرداوزونده مدیریت می شود که دقت تحویل اوزون را پس از O۳-O۲ مقدار مخلوط توسط اپراتور انتخاب می شود. بنابراین، می توان با انتخاب غلظت اوزون در یک محدوده پیوسته از ۱ تا ۱۰۰ گرم O، تیمار را سفارشی کرد۳. سپس ۲۰۰ میلی لیتر خون مخلوط شده با اوزون مستقیماً از کیسه استریل وارد جریان خون شد. بنابراین، درمان به یک ژنراتور اوزون، اکسیژن درجه پزشکی، یک سرنگ استریل و یک کیسه تایید شده مجهز به یک کانول داخل وریدی برای O نیاز داشت.۲-O۳-AHT. اگر یک هفته از O۲-O۳ -درمان AHT، امتیاز دلتای FSS 0 بود، جلسه دوم O۲-O۳-AHT با ۱۵۰ میلی لیتر خون تیمار شده در ۴۵ گرم در میلی لیتر اوزون در یک O انجام می شود.۲-O۳ مخلوط میانه ۱۵۵ میلی لیتر، CI۹۵ = 135-۲۴۵ میلی لیتر خون اوزون زده شد و برای هر بیمار تحت درمان مجددا وارد شد.۲۷،۳۷]. بیماران در ۳۰ روز پس از O دوم پیگیری شدند۲-O۳– جلسه AHT و درخواست تکمیل پرسشنامه FSS همانطور که قبلاً توافق شده بود.

آمار
داده ها جمع آوری و به عنوان میانگین انحراف معیار برای مقادیر کمی بیان شد. حجم نمونه با ارزیابی دادهها و ارزیابیهای پیشبینی با آزمون کوهن دی و دلتای گلس ارزیابی شد. استنتاج آماری، در صورت وجود، پس از آزمونهای ناپارامتریک مورد ارزیابی قرار گرفت. نمرات با آزمون کروسکال با p <0.05 ارزیابی شد. دادهها با نرمافزار SPSS v 24 و نرمافزار Stata برای نمودارها تهیه شد.
نتایج
جدول ۱ نتایج به دست آمده در تحقیق حاضر را خلاصه می کند.
جدول ۱. نتایج درمان خستگی در بیماران مبتلا به سندروم خستگی مزمن و آنسفالومیلیت میالژیک O۲-O۳-AHT (ضریبSD).
| تست کی دبلیو | |||||||
| قبل از درمان | بعد از درمان | دلتا% | p | ||||
| نرخ | |||||||
| همه بیماران | |||||||
| ۶.۸۲۵ 0.381 | ۲.۰۸۵ 1.503 | H = 293.6672 | |||||
| D% = 69.45 | ۰.۰۰۰۱> | ||||||
| ۰.۳۴ | |||||||
| بیماران مرد | |||||||
| ۶.۷۲۵ 0.450 | ۲.۷۲۵ 1.781 | H = 54.4956 | |||||
| D% = 59.48 | ۰.۰۰۰۱> | ||||||
| ۰.۸۶ | |||||||
| بیماران زن | |||||||
| ۶.۸۷۸ 0.329 | ۱.۷۴۸ 1.211 | H = 195.388 | |||||
| D% = 74.58 | ۰.۰۰۰۱> | ||||||
| ۰.۵۷ | |||||||
| داده های آماری و امتیاز شدت مقیاس خستگی | |||||||
| میانگین سنی (همه): | میانگین سنی (مرد): | میانگین سنی (زنان): | |||||
| ۳۳.۰۸۵ 13.503 SD | ۳۷.۴۰۶ 13.958 SD | ۳۰.۸۰۹ 12.730 SD | |||||
| از ۷ تا ۷ = 1 | از ۷ تا ۶ = 4 | از ۷ تا ۵ = 17 | از ۷ تا ۴ = 9 | از ۷ تا ۳ = 5 | از ۷ تا ۲ = 42 | از ۷ تا ۱ = 87 | |
| از ۶ تا ۶ = 0 | از ۶ تا ۵ = 6 | از ۶ تا ۴ = 3 | از ۶ تا ۳ = 0 | از ۶ تا ۲ = 11 | از ۶ به ۱ = 15 | از ۵ به ۱ = 0 |
تفکیک جنسیتی: مرد = 69; زن = 131 تفکیک سنی: <18 سال = 13; از ۱۸ تا ۲۹ سال = 89; ۳۰ سال = 98 همبستگی رتبه اسپیرمن ۰ p > 0.05 (ns) p = 0.33356، rho = 0.0687، S = 1424930. 3283. آزمون KS برای سنین p = 0.38765 (ns). امتیاز بالاتر دلتا ۷ تا ۱ = 43.۵%. بهترین عملکرد: ۷۷.۵%; برتری: ۵۱%.
هنگام درمان با O۲-O۳-AHT علائم خستگی در طی یک تا دو هفته اول از نمره ۷ (به معنی بدترین) به ۱ (به معنی بهترین، یعنی علائم کاملاً از بین رفتند) در تقریباً نیمی از بیماران تحت درمان با اکسیژن اوزون (۴۳.۵٪) حاصل شد. که تنها ۲۴.۶۴ درصد آنها مرد و بیش از ۷۵ درصد زن بودند.
درصد بیمارانی که نمره دلتا ۴-۶ امتیاز را تجربه کردند بالاتر از ۷۵٪ بود. به هر حال، تنها ۵ درصد بهبودهای بسیار جزئی و کاملاً ناچیز در علائم خستگی را نشان دادند. تفکیک سنی در کل جمعیت بیماران تصادفی شده تفاوتی را نشان نداد (۳۸۷۶۵/۰ = P)، بنابراین سن تأثیر معنیداری بر نتایج این بررسی نداشت. حدود ۶.۵ درصد از بیماران مبتلا به سندروم خستگی مزمن و آنسفالومیلیت میالژیک، با علائم خستگی و تحت درمان با O۲-O۳-AHT نوجوانان بودند. آزمون KW برای این گروه از افراد ۱۸.۷۷۷۸ (p = 0.00001) بود. تفکیک سنی و جنسی بر ارزیابی صحیح پرسشنامه شدت مقیاس خستگی تأثیری نداشت، زیرا آزمونهای KW در ۰۵/0p< معنیدار بود (جدول ۱))، و وقتی این نسبت به تعداد افراد جذب شده در کل ارجاع داده شد، میزان پاسخ مردان به درمان حدود ۶۰% (۵۹.۴۸%) ۱.۵ بیشتر از زنان بود که در حدود ۷۵% (۷۴.۵۸%) پاسخ دادند.
این ممکن است نشان دهد که بیماران مرد به ویژه به O۲-O۳ حساس هستند علیرغم محدوده سنی و زنان بیشتر واکنش نشان دادند اما با تفاوت های بیشتری نسبت به مردان. تقریباً ۸۰ درصد بیماران به طور بهینه به O۲-O۳-AHT پاسخ دادند و بیش از نیمی (۵۱%) با حداکثر امتیاز دلتای شدت مقیاس خستگی پاسخ دادند. شکل ۱ تفاوت چشمگیر نمره خستگی قبل و بعد از O۲-O۳-AHT را نشان می دهد.
هیچ بیماری پس از ۳ ماه بعد از درمان عوارض نامطلوبی را برای O۲-O۳-AHT نشان نداده است.
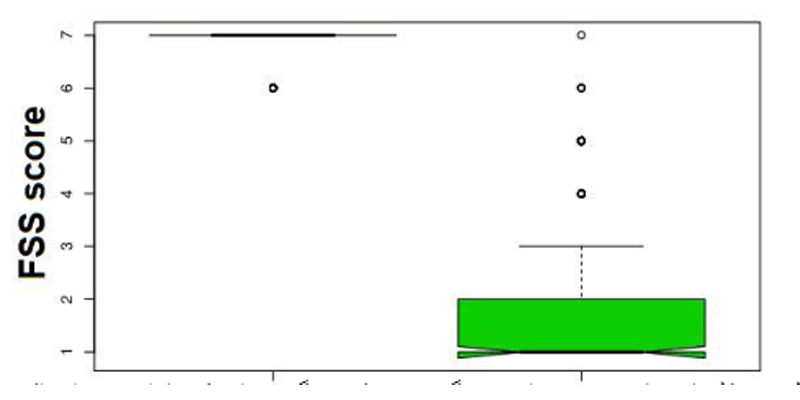
شکل ۱) شکل بالا نشان دهنده تغییرات چشمگیر در علائم خستگی بعد از یک ماه اتوهموتراپی اکسیژن- اوزون در ۲۰۰ بیمار درمان شده با O۲-O۳-AHT است.
بحث
با توجه به نتایج به دست آمده، O۲-O۳-AHT می تواند خستگی را بهبود ببخشد. نیمی از کل گروه مشارکت کننده در آزمایشات کلینیک ما اختلال ایمنی به علت عدم فعال شدن سلول های کشنده T و نقص عملکرد سلول های کشنده طبیعی را تجربه کرده اند. تعدیل ایمنی بدن از طریق تنظیم بقای سلول های بدن با پاسخ استرس اکسیداتیو، امکان دارد که راه حل معقولی به نظر برسد، اما اوزون درمانی یک رویکرد متقاعد کننده تر است. تاکنون هیچ دلیل قانع کننده ای داده نشده است که چرا اوزون می تواند خستگی بیماران را از بین ببرد و سلامتی را به آنان بازگرداند. شواهد اخیر از آن جهت جالب به نظر می رسد که دلایل بیماری زایی کووید۱۹ را با سندروم خستگی مزمن و آنسفالومیلیت میالژیک اختلال در پاسخ استرس مقایسه می کند. توانایی اوزون برای تعدیل سیستم Nrf2/Keap1/ARE و مسیرهای سیگنال دهی NO/eNOS این امکان را دارد که پیشنهاد های واقع بینانه ای را در رابطه با سازوکار O۲-O۳-AHT هنگام از بین بردن علائم خستگی مزمن ارائه دهد. در طول بیماری سندروم خستگی مزمن و آنسفالومیلیت میالژیک عملکرد میتوکندری به شدت بهم می ریزد و در نتیجه تمامی فعالیت های مرتبط با آن از جمله سیگنال دهی ROS و اختلالات التهابی دچار اختلال می شود. سندروم خستگی مزمن با افزایش سلول های CD4+CD25+Foxp3+ T تنظیمی شناخته می شود که ممکن است اوزون آن را تعدیل کند یا کاهش دهد. سلولهای CCR6+ Th17 در افراد مبتلا به سندروم خستگی مزمن IL-17 کمتری نسبت به افراد سالم ترشح می کند. فرکانس های در گردش سلول به طور قابل ملاحظه ای کم است که اوزون می تواند مقداری از آن ها را بازیابی کند. شناخت و بررسی ریز محیط ایمنی بدن بیماران سندروم خستگی مزمن برای روشن شدن چگونگی ایجاد خستگی و نحوه درمان آن از اهمیت بالایی برخوردار است. تا امروز، سازوکار هایی که باعث می شود O۲-O۳-AHT فعالیت بدنی را بازیابی کند و ناراحتی را تسکین ببخشد، به صورت کامل مشخص نشده است. پاسخ ایمنی نامنظم Treg و الگوی سیتوکین Th2 و Th17 مختل، امکان دارد که با اوزون و فعالیت های زیستی اکسید شده آن تعدیل و تنظیم شود. این فعالیت ارتباط تنگاتنگی با اعطای آنتی اکسیدان و ماشین آلاتی دارد که در انجام بهینه سازی پاسخ استرس مشارکت می کنند. به مقدار زیادی محصول جانبی اصلی خون ترکیب شده با اوزون، هیدروکسی نونال ۴ عامل تحریک تیرودوکسین ردوکتاز ۱ از طریق مسیر Nrf2 می شود و پس از آن سطح Tergs را افزایش می دهد. هر چند که شواهد کمی برای ساخت یک نظریه در ارتباط با چگونگی عملکرد O۲-O۳-ATH برای تسکین خستگی ناشی از سندروم خستگی مزمن و آنسفالومیلیت میالژیک وجود دارد، اما توانایی اوزون برای تعدیل ایمنی و التهاب از طریق مسیر Nrf2 ثابت شده است. علاوه بر این اوزون این امکان را دارد که میزان اکسید نیتریک و فعالیت eNOS را تنظیم کند. بیماران سندروم خستگی مزمن دارای اکسید نیتریک عادی در کنار سطوح طبیعی IL6، قبل و بعد از تمرین علائم خستگی دارند که نشانگر های استرس اکسیداتیو هستند که احتمالا با فعالیت اوزون از بین می روند. توانایی اوزون برای تعدیل فعل و انفعالات پیچیده بین استرس اکسیداتیو و التهاب مزمن امکان درک چگونگی تسکین سریع علائم خستگی بیماران سندروم خستگی مزمن و آنسفالومیلیت میالژیک را برای ما روشن سازد.
نتیجه گیری ها
بیماران دارای علائم سندرو خستگی مزمن و آنسفالومیلیت میالژیک تحت درمان با O۲-O۳-ATH قرار گرفتند و بهبودی سریع علائم خود را اعلام کردند. آزمایشات گسترده تر و بیشتری نیاز است تا سازوکار این فرآیند را مشخص کند و در آن آزمایشات باید ۹۵% بیماران درمان شده توانایی حرکت بدون درد و بازیابی سلامت خود را داشته باشند.
منابع مقاله آنسفالومیلیت میالژیک
۱. Deumer, U.S.; Varesi, A.; Floris, V.; Savioli, G.; Mantovani, E.; López-Carrasco, P.; Rosati, G.M.; Prasad, S.; Ricevuti, G. Myalgic
Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS): An Overview. J. Clin. Med. 2021, 10, 4786. [CrossRef]
۲. Barhorst, E.E.; Boruch, A.E.; Cook, D.B.; Lindheimer, J.B. Pain-related post-exertional malaise in Myalgic Encephalomyelitis/
Chronic Fatigue Syndrome (ME/CFS) and Fibromyalgia: A systematic review and three-level meta-analysis. Pain Med.
۲۰۲۱, pnab308. [CrossRef]
۳. Noor, N.; Urits, I.; Degueure, A.; Rando, L.; Kata, V.; Cornett, E.M.; Kaye, A.D.; Imani, F.; Narimani-Zamanabadi, M.; Varrassi,
G.; et al. A Comprehensive Update of the Current Understanding of Chronic Fatigue Syndrome. Anesthesiol. Pain Med. 2021,
۱۱, e113629. [CrossRef]
۴. Lim, E.J.; Son, C.G. Prevalence of Chronic Fatigue Syndrome (CFS) in Korea and Japan: A Meta-Analysis. J. Clin. Med. 2021,
۱۰, ۳۲۰۴. [CrossRef]
۵. Tirelli, U.; Lleshi, A.; Berretta, M.; Spina, M.; Talamini, R.; Giacalone, A. Treatment of 741 Italian patients with chronic fatigue
syndrome. Eur. Rev. Med. Pharmacol. Sci. 2013, 17, 2847–۲۸۵۲.
۶. Tirelli, U.; Cirrito, C.; Pavanello, M.; Del Pup, L.; Lleshi, A.; Berretta, M. Oxygen-ozone therapy as support and palliative therapy
in 50 cancer patients with fatigue—A short report. Eur. Rev. Med. Pharmacol. Sci. 2018, 22, 8030–۸۰۳۳. [PubMed]
۷. Arpino, C.; Carrieri, M.P.; Valesini, G.; Pizzigallo, E.; Rovere, P.; Tirelli, U.; Conti, F.; Dialmi, P.; Barberio, A.; Rusconi, N.; et al.
Idiopathic chronic fatigue and chronic fatigue syndrome: A comparison of two case-definitions. Ann. Dell’istituto Super. Di Sanità
۱۹۹۹, ۳۵, ۴۳۵–۴۴۱.
۸. Tirelli, U.; Chierichetti, F.; Tavio, M.; Simonelli, C.; Bianchin, G.; Zanco, P.; Ferlin, G. Brain positron emission tomography (PET) in
chronic fatigue syndrome: Preliminary data. Am. J. Med. 1998, 105, 54S–58S. [CrossRef]
۹. Montoya, J.G.; Holmes, T.H.; Anderson, J.N.; Maecker, H.T.; Rosenberg-Hasson, Y.; Valencia, I.J.; Chu, L.; Younger, J.W.; Tato,
C.M.; Davis, M.M. Cytokine signature associated with disease severity in chronic fatigue syndrome patients. Proc. Natl. Acad. Sci.
USA 2017, 114, E7150–E7158. [CrossRef] [PubMed]
۱۰. Tirelli, U.; Marotta, G.; Improta, S.; Pinto, A. Immunological abnormalities in patients with chronic fatigue syndrome. Scand. J.
Immunol. 1994, 40, 601–۶۰۸. [CrossRef]
۱۱. Tirelli, V.; Pinto, A.; Marotta, G.; Crovato, M.; Quaia, M.; De Paoli, P.; Galligioni, E.; Santini, G. Clinical and immunologic study of
۲۰۵ patients with chronic fatigue syndrome: A case series from Italy. Arch. Intern. Med. 1993, 153, 116–۱۲۰. [CrossRef] [PubMed]
۱۲. Estévez-López, F.; Mudie, K.; Wang-Steverding, X.; Bakken, I.J.; Ivanovs, A.; Castro-Marrero, J.; Nacul, L.; Alegre, J.; Zalewski, P.;
Słomko, J.; et al. Systematic Review of the Epidemiological Burden of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome
Across Europe: Current Evidence and EUROMENE Research Recommendations for Epidemiology. J. Clin. Med. 2020, 9, 1557.
[CrossRef]
۱۳. Vincent, A.; Brimmer, D.J.; Whipple, M.O.; Jones, J.F.; Boneva, R.; Lahr, B.D.; Maloney, E.; St Sauver, J.L.; Reeves, W.C. Prevalence,
incidence, and classification of chronic fatigue syndrome in Olmsted County, Minnesota, as estimated using the Rochester
Epidemiology Project. Mayo Clin. Proc. 2012, 87, 1145–۱۱۵۲. [CrossRef]
۱۴. Lim, E.J.; Ahn, Y.C.; Jang, E.S.; Lee, S.W.; Lee, S.H.; Son, C.G. Systematic review and meta-analysis of the prevalence of chronic
fatigue syndrome/myalgic encephalomyelitis (CFS/ME). J. Transl. Med. 2020, 18, 100. [CrossRef]
۱۵. Capelli, E.; Lorusso, L.; Ghitti, M.; Venturini, L.; Cusa, C.; Ricevuti, G. Chronic fatigue syndrome: Features of a population of
patients from northern Italy. Int. J. Immunopathol. Pharmacol. 2015, 28, 53–۵۹. [CrossRef]
۱۶. Spazzapan, S.; Bearz, A.; Tirelli, U. Fatigue in cancer patients receiving chemotherapy. Anal. Publ. Stud. Ann. Oncol. 2004,
۱۵, ۱۵۷۶.
۱۷. Solomon, L.; Reeves, W.C. Factors influencing the diagnosis of chronic fatigue syndrome. Arch. Intern. Med. 2004, 164, 2241–۲۲۴۵.
[CrossRef]
۱۸. Brenna, E.; Araja, D.; Pheby, D.F.H. Comparative Survey of People with ME/CFS in Italy, Latvia, and the UK: A Report on
Behalf of the Socioeconomics Working Group of the European ME/CFS Research Network (EUROMENE). Medicina 2021, 57, 300.
[CrossRef]
۱۹. Kennedy, G.; Abbot, N.C.; Spence, V.; Underwood, C.; Belch, J.J. The specificity of the CDC-1994 criteria for chronic fatigue
syndrome: Comparison of health status in three groups of patients who fulfill the criteria. Ann. Epidemiol. 2004, 14, 95–۱۰۰.
[CrossRef] [PubMed]
۲۰. Kuratsune, H. Diagnosis and Treatment of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. Brain Nerve 2018, 70, 11–۱۸.
[PubMed]
۲۱. Carruthers, B.M.; van de Sande, M.I.; De Meirleir, K.L.; Klimas, N.G.; Broderick, G.; Mitchell, T.; Staines, D.; Powles, A.C.; Speight,
N.; Vallings, R.; et al. Myalgic encephalomyelitis: International Consensus Criteria. J. Intern. Med. 2011, 270, 327–۳۳۸. [CrossRef]
[PubMed]
۲۲. Bruun Wyller, V.; Bjørneklett, A.; Brubakk, O.; Festvåg, L.; Follestad, I.; Malt, U.; Malterud, K.; Nyland, H.; Rambøl, H.; Stubhaug,
B.; et al. Diagnosis and Treatment of Chronic Fatigue Syndrome/Myalgic Encephalopathy (CFS/ME) [Internet]; Report from Norwegian
Knowledge Centre for the Health Services (NOKC) No. 09-2006; Knowledge Centre for the Health Services at The Norwegian
Institute of Public Health (NIPH): Oslo, Norway, 2006.
۲۳. Chew-Graham, C.; Dowrick, C.; Wearden, A.; Richardson, V.; Peters, S. Making the diagnosis of Chronic Fatigue Syndrome/
Myalgic Encephalitis in primary care: A qualitative study. BMC Fam. Pract. 2010, 11, 16. [CrossRef]
۲۴. Son, C.G. Differential diagnosis between “chronic fatigue” and “chronic fatigue syndrome”. Integr. Med. Res. 2019, 8, 89–۹۱.
[CrossRef]
۲۵. Nelsen, D.A., Jr. Differential diagnosis for chronic fatigue syndrome. Am. Fam. Physician 2003, 67, 252.
۲۶. Craig, T.; Kakumanu, S. Chronic fatigue syndrome: Evaluation and treatment. Am. Fam. Physician 2002, 65, 1083–۱۰۸۹.
۲۷. Tirelli, U.; Cirrito, C.; Pavanello, M. Ozone therapy is an effective therapy in chronic fatigue syndrome: Result of an Italian study
in 65 patients. Ozon Ther. 2018, 3, 27–۳۰. [CrossRef]
۲۸. Morelli, L.; Bramani, S.C.; Morelli, F.C. Oxygen-ozone therapy in meningoencephalitis and chronic fatigue syndrome. Treat. Field
Compet. Sports Case Rep. Ozone Ther. 2019, 4, 20–۲۳.
۲۹. Borrelli, E.; Bocci, V. A novel therapeutic option for Chronic Fatigue Syndrome and Fibromyalgia. Riv. Ital. Ossig.-Ozonoterap.
۲۰۰۲, ۱, ۱۴۹–۱۵۳.
۳۰. Viebahn-Haensler, R.; León Fernández, O.S. Ozone in Medicine. The Low-Dose Ozone Concept and Its Basic Biochemical
Mechanisms of Action in Chronic Inflammatory Diseases. Int. J. Mol. Sci. 2021, 22, 7890. [CrossRef]
۳۱. Bjørklund, G.; Dadar, M.; Pivina, L.; Do¸sa, M.D.; Semenova, Y.; Maes, M. Environmental, Neuro-immune, and Neuro-oxidative
Stress Interactions in Chronic Fatigue Syndrome. Mol. Neurobiol. 2020, 57, 4598–۴۶۰۷. [CrossRef]
۳۲. Chirumbolo, S.; Valdenassi, L.; Simonetti, V.; Bertossi, D.; Ricevuti, G.; Franzini, M.; Pandolfi, S. Insights on the mechanisms of
action of ozone in the medical therapy against COVID-19. Int. Immunopharmacol. 2021, 96, 107777. [CrossRef]
۳۳. Paul, B.D.; Lemle, M.D.; Komaroff, A.L.; Snyder, S.H. Redox imbalance links COVID-19 and myalgic encephalomyelitis/chronic
fatigue syndrome. Proc. Natl. Acad. Sci. USA 2021, 118, e2024358118. [CrossRef] [PubMed]
۳۴. Baker, R.; Shaw, E.J. Diagnosis and management of chronic fatigue syndrome or myalgic encephalomyelitis (or encephalopathy):
Summary of NICE guidance. BMJ 2007, 335, 446–۴۴۸. [CrossRef]
۳۵. Neuberger, G.B. Measures of fatigue Arthritis and Rheumatisms. Arthritis Care Res. 2003, 48, S175–S183. [CrossRef]
۳۶. Tirelli, U.; Franzini, M.; Valdenassi, L.; Pisconti, S.; Taibi, R.; Torrisi, C.; Pandolfi, S.; Chirumbolo, S. Fatigue in post-acute sequelae
of SARS-CoV2 (PASC) treated with oxygen-ozone autohemotherapy-preliminary results on 100 patients. Eur. Rev. Med. Pharmacol.
Sci. 2021, 25, 5871–۵۸۷۵. [PubMed]
۳۷. lvis, A.M.; Ekta, J.S. Ozone therapy: A clinical review. J. Nat. Sci. Biol. Med. 2011, 2, 66–۷۰.
۳۸. Anderson, G.; Maes, M. Mitochondria and immunity in chronic fatigue syndrome. Prog. Neuro.-Psychopharmacol. Biol. Psychiatry
۲۰۲۰, ۱۰۳, ۱۰۹۹۷۶. [CrossRef]
۳۹. Maes, M.; Twisk, F.N.; Kubera, M.; Ringel, K. Evidence for inflammation and activation of cell-mediated immunity in Myalgic
Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS): Increased interleukin-1, tumor necrosis factor-
, PMN-elastase,
lysozyme and neopterin. J. Affect Disord. 2012, 136, 933–۹۳۹. [CrossRef]
۴۰. Maes, M.; Twisk, F.N.; Ringel, K. Inflammatory and cell-mediated immune biomarkers in myalgic encephalomyelitis/chronic
fatigue syndrome and depression: Inflammatory markers are higher in myalgic encephalomyelitis/chronic fatigue syndrome
than in depression. Psychother. Psychosom. 2012, 81, 286–۲۹۵. [CrossRef] [PubMed]
۴۱. Brenu, E.W.; Huth, T.K.; Hardcastle, S.L.; Fuller, K.; Kaur, M.; Johnston, S.; Ramos, S.B.; Staines, D.R.; Marshall-Gradisnik,
S.M. Role of adaptive and innate immune cells in chronic fatigue syndrome/myalgic encephalomyelitis. Int. Immunol. 2014,
۲۶, ۲۳۳–۲۴۲. [CrossRef]
۴۲. Wei, M.; Tu, L.; Liang, Y.H.; Liu, J.; Gong, Y.J.; Zhang, J.H.; Zhang, Y.H. Effects of ozone exposure on percentage of
CD4(+)CD25(high)Foxp(3+) regulatory T cells and mRNA expression of Foxp3 in asthmatic rats. Zhonghua Lao Dong Wei Sheng
Zhi Ye Bing Za Zhi 2013, 31, 693–۶۹۶.
۴۳. Broderick, G.; Fuite, J.; Kreitz, A.; Vernon, S.D.; Klimas, N.; Fletcher, M.A. A formal analysis of cytokine networks in chronic
fatigue syndrome. Brain Behav. Immun. 2010, 24, 1209–۱۲۱۷. [CrossRef]
۴۴. Che, L.; Jin, Y.; Zhang, C.; Lai, T.; Zhou, H.; Xia, L.; Tian, B.; Zhao, Y.; Liu, J.; Wu, Y.; et al. Ozone-induced IL-17A and neutrophilic
airway inflammation is orchestrated by the caspase-1-IL-1 cascade. Sci. Rep. 2016, 6, 18680. [CrossRef] [PubMed]
۴۵. Chen, Z.H.; Saito, Y.; Yoshida, Y.; Sekine, A.; Noguchi, N.; Niki, E. 4-Hydroxynonenal induces adaptive response and enhances
PC12 cell tolerance primarily through induction of thioredoxin reductase 1 via activation of Nrf2. J. Biol. Chem. 2005,
۲۸۰, ۴۱۹۲۱–۴۱۹۲۷. [CrossRef] [PubMed]
۴۶. Wang, X.; Dong, H.; Li, Q.; Li, Y.; Hong, A. Thioredoxin induces Tregs to generate an immunotolerant tumor microenvironment
in metastatic melanoma. Oncoimmunology 2015, 4, e1027471. [CrossRef] [PubMed]
۴۷. Meeus, M.; Van Eupen, I.; Hondequin, J.; De Hauwere, L.; Kos, D.; Nijs, J. Nitric oxide concentrations are normal and unrelated to
activity level in chronic fatigue syndrome: A case-control study. In Vivo 2010, 24, 865–۸۶۹.
۴۸. Robinson, M.; Gray, S.R.; Watson, M.S.; Kennedy, G.; Hill, A.; Belch, J.J.; Nimmo, M.A. Plasma IL-6, its soluble receptors and
F2-isoprostanes at rest and during exercise in chronic fatigue syndrome. Scand. J. Med. Sci. Sports 2010, 20, 282–۲۹۰. [CrossRef]
۴۹. Milne, G.L.; Musiek, E.S.; Morrow, J.D. F2-isoprostanes as markers of oxidative stress in vivo: An overview. Biomarkers 2005, 10
(Suppl. S1), S10–S23. [CrossRef] [PubMed]

