پسوریازیس ولگاریس یک بیماری التهابی پوستی با واسطه ایمنی طولانی مدت است که با لکه های پوستی قرمز، خارش دار و پوسته پوسته تبیین می شود. بیماران به طور کلی از تغییر شکل، ناتوانی و بیماری های همراه رنج می برند [۱]. ما در این مقاله قصد داریم اثرات درمان پسوریازیس با اوزون درمانی به روش سالین را بررسی کنیم. به طور کلی عوامل خطرزای محیطی مانند عفونتهای میکروبی، چاقی و قرار گرفتن در معرض اشعه ماوراء بنفش میتوانند موجب شروع عارضه در بیماران مبتلا به حساسیت ژنتیکی پسوریاتیک پنهان شوند [۲]. سلولهای دندریتیک پلاسماسیتوئید (pDCs) بهعنوان محرکهایی در آبشار التهابی در پلاکهای پسوریاتیک شناسایی شدهاند [۳].
pDCهای موضعی در ضایعات پوستی پسوریازیس می توانند با تولید IL-23، IL-12، IL-6 و فاکتور نکروز تومور (TNF)-a، تمایز سلول های T helper (Th) را به زیر مجموعه های Th17، Thl و Th22 فعال و القا کنند. [۴، ۵]. شواهد نشان داده اند که نسبت سلول های Th1 و Th17 در ضایعات پوستی و خون محیطی بیماران پسوریازیس به طور قابل توجهی در مقایسه با افراد عادی افزایش یافته است. سلول های Th2 و سیتوکین های مرتبط با آنها. از جمله IL-4، IL-10، و IL-13، نسبت های کاهش یافته را نشان می دهند [۶، ۷].
بنابراین، مسدود کردن فعالسازی سلولهای T بیماریزا، بهویژه زیرمجموعه Th17، منجر به درمانهای بسیاری مانند assecukinu¬mab [8]، ixekizumab [9] و brodalumab [10] شده است. با این حال، مشکلات مربوط به عوامل بیولوژیکی، مانند تک اثر، هزینه های بالا و مقاومت دارویی، نگرانی عمده بسیاری از بیماران و پزشکان می باشد. علاوه بر این، مسیرهای NF-KB تحریک شده توسط سیتوکین های التهابی متعدد به طور اساسی در اپیدرم پسوریازیس فعال می شوند که منجر به تکثیر بیش از حد کراتینوسیت ها می شود [۱۱، ۱۲]. فعال شدن گیرنده شبه ۲ (TLR2) در کراتینوسیت ها می تواند منجر به جابجایی هسته ای NF-KB و آزادسازی سایتوکاین های پیش التهابی TNF-a و IL-8 گردد [۱۳]. میکروارگانیسمها و اجزای آنها و الگوهای مولکولی مرتبط با بیماریزا (PAMPs) میتوانند TLR2 را برای تحریک سیستم ایمنی برانگیزند [۱۴]. بنابراین، هدف قرار دادن مسیر TLR2/NF-KB یک استراتژی درمانی جدید بالقوه است.
موارد استفاده از اوزون در پزشکی
اوزون برای اولین بار به دلیل خاصیت اکسید کننده قوی به عنوان یک عامل استریل کننده به صورت بالینی مورد استفاده واقع شد. به طور گسترده ای برای درمان بیش از ۵۰ بیماری مختلف پاتولوژیک، از جمله بیماری های عفونی پوست [۱۵-۱۸]، بیماری های آلرژیک [۱۹، ۲۰]، بیماری های پوسته پوسته اریتم [۲۱، ۲۲]، بهبود زخم و بازیابی جراحت [۲۳] استفاده شده است. مکانیسم های عمل اوزون ممکن است زمینه ساز اثرات ضد میکروبی، تنظیم ایمنی، دفاع آنتی اکسیدانی، اصلاح اپی ژنتیک، بیوسنتز، مسکن ها و اتساع عروق باشد [۲۴]. آمادهسازیهای پزشکی اوزون کنونی برای پوست در طبقهبندیهای اولیه زیر قرار میگیرند: هیدروتراپی اوزون ، روغن اوزون دار موضعی، اتوهموتراپی اوزون (OAHT) و تزریق حفره گاز اوزون / نقطه طبی [۲۴].
مطالعات اخیر نشان داده است که کنترل دقیق غلظت اوزون می تواند باعث تولید سیتوکین های مختلف مانند IFN-y، IL-6 و TNF-a شود [۲۵]. اوزون می تواند سیستم آنزیمی آنتی اکسیدانی بدن را برای تولید عوامل مهارکننده رادیکال های آزاد تحریک و فعال کند، برخی از رادیکال های آزاد تولید شده توسط واکنش های التهابی را حذف نموده و در تولید عوامل التهابی در طول توسعه بیماری دخالت داشته باشد [۲۶]. با این حال، مکانیسم های دقیق اوزون درمانی با روش سالین DIV ( هاوارد رابینس) در درمان بیماری ها باید بیشتر توضیح داده شود.
در این مطالعه، ما اثربخشی درمانی یک درمان کوتاه مدت اوزون را برای بیماران پسوریازیس ارزیابی کردیم. ما مکانیسمهای بالقوه اوزوندرمانی موضعی برای پسوریازیس را با استفاده از مدل افراد در حال درمان پسوریازیسمانند ناشی از imiquimod (IMQ) بررسی کردیم. ما دریافتیم که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) با مهار مسیر NF-KB، پاسخ های التهابی در پسوریازیس را کاهش می دهد. نتایج ما نشان می دهد که اوزون تراپی یک درمان ایمن و موثر برای پسوریازیس است و نیازمند ارزیابی ها و کاربردهای بالینی بیشتر می باشد.
Title
Subtitle
مواد و روش ها
بیماران
این مطالعه توسط هیئت بررسی نهادی (IRB) بیمارستان سوم شیانگیا، دانشگاه مرکزی جنوبی، چانگشا، هونان، چین تایید شد. در مجموع ۱۰ بیمار پسوریازیس با تشخیص پسوریازیس ولگاریس در این مطالعه مورد بررسی قرار گرفتند و فرمهای رضایت کتبی توسط همه افراد امضا شد. اطلاعات بالینی بیماران در جدول تکمیلی ۱ نشان داده شده است. امتیازات PASI برای ارزیابی فعالیت بیماری استفاده شد. معیارهای ورود به مطالعه برای بیماران بین ۱۸ تا ۶۰ سال و مبتلا به پسوریازیس ولگاریس بود که با معاینات پاتولوژیک تشخیص داده شد. معیارهای خروج شامل حساسیت به آب یا روغن اوزون دار بارداری یا شیردهی؛ بیماری های سیستمیک شدید؛ و دریافت کورتیکواستروئیدها، مشتقات ویتامین D3، مهارکننده های ایمنی، درمان بیولوژیکی یا رتینوئیدهای خوراکی در ۲ هفته گذشته بود.
انسان
انسان های BALB/c از Hunan SJA Laboratory Animal Co., Ltd. خریداری شدند. در سن ۶ هفتگی، انسانهای ماده به مدت ۱ هفته به صورت تطبیقی تغذیه شدند و برای همه آزمایشها مورد استفاده قرار گرفتند. همه حیوانات در مرکز آزمایش حیوانات دانشگاه مرکزی جنوب و مطابق با قوانین مربوطه و دستورالعملهای سازمانی بزرگ شده و نگهداری شدند. همه رویههای حیوانی توسط کمیته مراقبت و استفاده از حیوانات پزشکی بیمارستان سوم شیانگیا دانشگاه مرکزی جنوبی تأیید و نظارت شد.
اوزون تراپی موضعی
همه شرکتکنندگان با یک دوش آب اوزون دار (3.0±۱.۵ میلیگرم در لیتر، HZ-2601B، فناوری مراقبت بهداشتی هونان، چانگشا، چین) به مدت ۱۵ دقیقه، یک بار در روز تحت درمان قرار گرفتند، سپس با روغن اوزون دار موضعی (20160522، با مقدار تقریبی) تحت درمان قرار گرفتند. مقدار پراکسید ۲۰۰۰-۲۴۰۰ میلی مول معادل/کیلوگرم، فناوری مراقبت های بهداشتی هونان، چانگشا، چین) دو بار در روز، به مدت ۱۴ روز استعمال شد.
بیشتر بخوانید: پسوریازیس در اطفال
ارزیابی عکسهای بالینی و انعکاس تصاویر میکروسکوپ کانفوکال ضایعات پوستی
مدل انسان پسوریازیس و مداخله اوزون القا شده توسط IMQ
همه افراد فقط اوزون درمانی رایگان دریافت کردند. آنها هیچ درمان و داروی دیگری در طول آزمایش دریافت نکردند. این مداخله ۱۴ روز به طول انجامید. عکسهای Oinical، امتیازات PASI و تصاویر RCM توسط همان پزشکان حرفهای به منظور مقایسه شدت بیماری قبل و بعد از درمان ارزیابی شدند. طبق متون، امتیازات PASI شامل ناحیه ضایعات پوستی، اریتم، پوسته پوسته شدن و ضخیم شدن بود [۲۷]. هر آزمونه توسط RCM مورد ارزیابی قرار گرفت.
اهای ماده BALB/c (سن ۸-۶ هفته) تحت شرایط مناسب تغذیه شدند. انسان ها روزانه با کرم موضعی IMQ 5% (Sichuan Med-Shine Pharmaceutical Co., Ltd., H20030128, Sichuan, China) روی پوست تراشیده شده پشتی خود به مدت ۷ روز متوالی آغشته شدند. انسان های گروه کنترل با همان مقدار کرم خودرو تحت درمان قرار گرفتند. همه انسان های IMQ بهطور تصادفی به سه گروه تقسیم شدند: گروه بدون مداخله (گروه IMQ)، گروه درمان با اوزون (IMQ+Ozone)، و گروه درمان با کرم خودرو (IMQ+ Vehicle). گروه تحت درمان با اوزون با آب اوزون دار (HZ-2601B, Hunan Health Care Technology Co., Ltd., Changsha, China) به مدت ۱۵ دقیقه یک بار در روز تحت درمان قرار گرفتند و سپس با روغن اوزون دار موضعی کار را ادامه دادند (۲۰۱۶۰۵۲۲, Hunan Health Care Technology Co. .، آموزشی ویبولیتین، چانگشا، چین). گروه تحت درمان دوم کرم خودرو آب لوله کشی و روغن پایه را با همان فرکانس دریافت کردند. مداخله به مدت ۷ روز ادامه داشت. عکس های بالینی و نمرات PASI به منظور ارزیابی ویژگی های فنوتیپی جمع آوری شد. در روز هفتم، تمام انسان ها برای جمعآوری ضایعات پوستی، بافتهای طحال و غدد لنفاوی قربانی شدند.
جداسازی سلول های CD4+ T
سلول های تک هسته ای خون محیطی (PBMCs) از خون محیطی بیماران قبل و بعد از درمان توسط سانتریفیوژ با استفاده از یک محیط گرادیان چگالی (GE Healthcare، شیکاگو، IL، ایالات متحده آمریکا) جدا شدند. سلول های CD4+ T با یک انتخاب مثبت با استفاده از دانه های Miltenyi مطابق دستورالعمل سازنده (Miltenyi Biotec، Bergisch Gladbach، آلمان) جدا شدند. سپس سلولهای CD4+ T جدا شده برای آزمایشهای بعدی جمعآوری شدند. در آزمایش انسان، سلولهای CD4 + T از سوسپانسیونهای تک سلولی طحال با استفاده از کیت جداسازی سلولهای CD4 + T انسان از Miltenyi Biotec (برگیش گلادباخ، آلمان) خالص شدند.
Title
Subtitle
فلوسیتومتری
نشانگرهای سطحی، سیتوکینها و فاکتورهای رونویسی با استفاده از تحلیلگر سلولی FACSCanto II ( BD Biosciences، San Jose، CA، USA ) شناسایی شدند. برای تشخیص سیتوکین، سلول های جدا شده در شرایط آزمایشگاهی به مدت ۴ ساعت با فوربول ۱۲-میریستات ۱۳-استات (PMA) و یونومایسین (Sigma-Aldrich, St. Louis, MO, USA) با افزودن GolgiPlug (BD Biosciences, San Jose, CA, USA)، برای ترویج آزادسازی سیتوکین ها تحریک شدند. پس از آن، سلول های تحت درمان با آنتی بادی علیه نشانگرهای سطحی روی یخ به مدت ۳۰ دقیقه در تاریکی انکوبه شدند. برای رنگآمیزی درون سلولی، سلولها با یک مجموعه بافر رنگآمیزی فاکتور رونویسی P3 (FOXP3) ثابت و نفوذپذیر شدند و سپس با آنتیبادیهای فلورسنت به مدت ۳۰ دقیقه اضافی رنگآمیزی شدند.
یخ در تاریکی آیتم ها با استفاده از نرم افزار (FlowJo LLC, Ashland, OR, USA) جمع آوری و تجزیه و تحلیل شدند. آنتی بادی های زیر از BioLegend (سان دیگو، کالیفرنیا، ایالات متحده آمریکا) به دست آمد و در این مطالعه مورد استفاده واقع شد: FITC ضد انسان IFN-y (کاتالوگ شماره ۵۰۵۸۰۵)، Alexa Fluor 647 ضد انسان IL-17 A (کاتالوگ شماره ۵۰۶۹۱۱). ، ضد انسان PE IL-4 (کاتالوگ شماره ۵۰۴۱۰۳)، PE ضد انسان FOXP3 (شماره کاتالوگ ۱۲۶۴۰۳)، PerCP /Cy5.5 ضد انسان CD4 (کاتالوگ شماره ۱۰۰۵۴۰) و FITC ضد انسان CD3 (شماره کاتالوگ ۵۱۰۰۲۰۳). IL-4 ضد انسان Phycoerythrin (PE) از BD Biosciences (کاتالوگ شماره ۵۰۴۱۰۳, San Jose, CA, USA) و CD25 ضد انسان APC از eBioscience (کاتالوگ شماره ۱۰۲۰۱۱, San Diego, CA, USA) به دست آمد.
بیشتر بخوانید: درمان های سیستمیک پسوریازیس
qPCR
RNA کل با استفاده از TRizol طبق دستورالعمل سازنده (Thermo Fisher Scientific, Waltham, MA, USA) از سلول ها یا بافت های پوست استخراج شد. mRNA با کیت معرف PrimeScript® RT (Takara Biomedical Technology Co., Ltd., Kusatsu, Shiga, Japan) با ۱ میکروگرم از کل RN A در هر واکنش رونویسی معکوس شد. مخلوط واکنش برای PCR بلادرنگ حاوی ۲ میکرولیتر cDN A، ۱۰ میکرولیتر SYBR Premix Ex Taq™ (Takara Biomedical Technology Co., Ltd., Kusatsu, Shiga, Japan) و ۴۰۰ نانومتر پرایمرهای حسی و ضد حس برای حجم نهایی ۲۰ میکرولیتر qPCR بر روی یک ترموسایکلر LightCycler® ۹۶ (Roche, Rotkreuz, Switzerland) انجام شد. مقدار بیان ژن با استفاده از روش ۲-i’let محاسبه و به گلیسرآلدئید-۳- فسفات دهیدروژناز (GAPDH) نرمال شد. پرایمرها در جدول تکمیلی ۲ نشان داده شده است.
وسترن بلاتینگ
سلول های CD4+ T لیز شده و پروتئین ها با استفاده از یک معرف استخراج هسته ای (Boster Biological Technology، Pleasanton، CA، USA) استخراج شدند. پروتئین ها با معرف برادفورد (Thermo Fisher Scientific, Waltham, MA, USA) و به دنبال آن الکتروفورز ژل دودسیل سولفات-پلی آکریل آمید عمودی ۱۲ درصد تعیین شد. سپس پروتئین ها به یک غشای پلی وینیهدن دی فلوراید (PVDF) (سیگما-آلدریچ، سنت لوئیس، MO، ایالات متحده آمریکا) منتقل شدند. غشای PVDF در شیر بدون چربی ۵ درصد برای دمای اتاق ۱ کلاه مسدود شد، سپس با آنتی بادی علیه P65 (GB11142، ۱:۱۰۰۰، ووهان) انکوبه شد.
Servicebio Technology Co., Ltd., Wuhan, China) یا P50 (ab7971, 1:5000, Abeam, Cambridge, MA, USA) برای ۱۲-۱۶ ساعت در ۴ درجه سانتیگراد و به دنبال آن انکوباسیون با آنتی بادی IgG انسان ضد خرگوش (H&L) (GenScript، Piscataway، NJ، USA). پروتئینها با کیت تشخیص وسترن بلات افزایشیافته (ECL) شناسایی شدند (Thermo Fisher Scientific, Waltham, MA, USA). کمی سازی P65 و P50 با چگالی سنجی به GAPDH نرمال شد.
تجزیه و تحلیل بافت شناسی
بافت های پوست همه بیماران و انسان ها در فرمالین تثبیت شد و در پارافین جاسازی شد (شرکت فناوری ووهان سرویسبیو، ویبولیتین، ووهان، چین). مقاطع (۶ میکرومتر) با هماتوکسیلین و ائوزین رنگ آمیزی شدند و در دمای اتاق نگهداری شدند. ضخامت اپیدرم و سلول های التهابی نفوذی بررسی شد.
رنگ آمیزی المونوهیستوشیمی
مقاطع (6 um) با P50 (کاتالوگ شماره BS1249، شرکت فناوری Bioworld، آموزشی ویبولیتین، نانجینگ، چین)، P65 (کاتالوگ شماره ۱۰۷۴۵-۱-AP، Proteintech، Rosemont، IL، USA) و آنتی بادی های TLR2 رنگ آمیزی شدند. (شماره کاتالوگ ab213676, Abeam, Cambridge, MA, USA) طبق دستورالعمل سازنده. تجزیه و تحلیل تصویر با استفاده از میکروسکوپ فلورسنت و نرم افزار تحلیل Leica Qwin Std (Leica، Wetzlar، آلمان) انجام گرفت.
توالی با توان بالا
پروفایل های رونوشت سمت چپ و راست ضایعات پوستی از مدل های انسان خودکنترلی و ضایعات از پوست پشتی انسان در گروه کنترل و گروه IMQ به دست آمد. به طور خلاصه، RNA کل از این نمونه های پوست استخراج شد. mRNA غنی شده، تکه تکه شده و برای سنتز cDNA استفاده شد. قطعات cDNA توسط PCR تکثیر شدند و اندازه و کیفیت کتابخانه توالی یابی با استفاده از یک Bioanalyzer Agilent 2100
(Agilent, Santa Oara, CA, USA) تعیین شد. این کتابخانه با استفاده از یک پلت فرم توالی یابی با توان بالای HiSeq X Ten (Illumina Inc., San Diego, CA, USA) توالی یابی شد. ژنهای بیانشده متفاوت در بین نمونههای انتخابشده توسط آنالیز غنیسازی مسیر کیوتو دایرهالمعارف ژنها و ژنومها (KEGG) مورد تجزیه و تحلیل قرار گرفت.
تحلیل آماری
تمام نمودارها و نمودارهایی که داده های تجمعی را گزارش می دهند با استفاده از GraphPad Prism 6.0 (نرم افزار GraphPad، سن دیگو، کالیفرنیا، ایالات متحده آمریکا) تولید شدند. داده ها به صورت میانگین ± خطای استاندارد میانگین (SEM) نشان داده می شوند. توزیع میانگین ها با آزمون های ناپارامتریک (SPSS 18.0، IBM، Armonk، NY، USA) مورد تجزیه و تحلیل قرار گرفت. تفاوت در درمان های فردی با استفاده از آزمون t زوجی مورد تجزیه و تحلیل قرار گرفت. معنی داری آماری (*P P<0.05، **P <0.01، ***P <0.001) با استفاده از آزمون t 2-tailed unpaired Student t برای مقایسه بین ۲ گروه و تجزیه و تحلیل واریانس یک طرفه (ANOVA) با موارد مرتبط تست های تعقیبی برای مقایسه های چندگانه ارزیابی شد.
نتایج
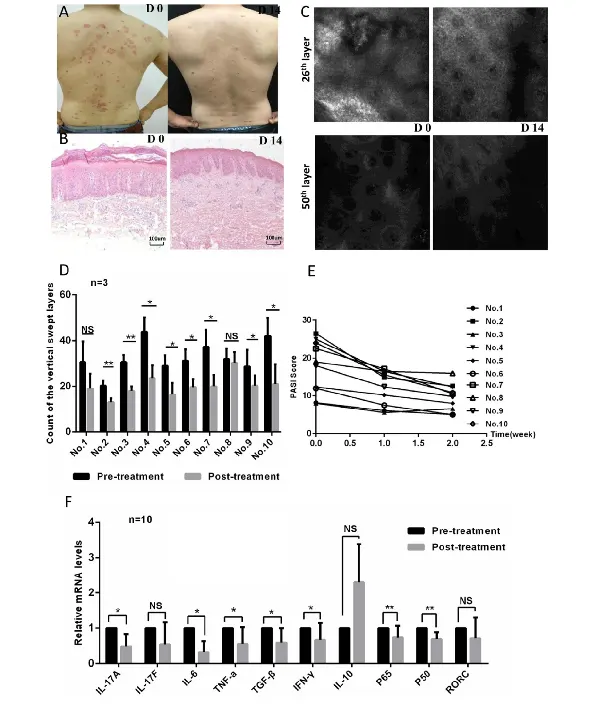
درمان موضعی اوزون موجب بهبود وضعیت ضایعات پوستی در پسوریازیس می شود. به منظور ارزیابی اثربخشی اوزون درمانی با روش سالین DIV ( هاوارد رابینس) بر پسوریازیس، ده بیمار با تشخیص پسوریازیس از طریق هیستوپاتولوژی پوست را در این مطالعه مورد بررسی قرار دادیم. وضعیت پسوریازیس هر بیمار با استفاده از نمره ناحیه پسوریازیس و شاخص شدت (P ASI) تعیین شد که در طی دو هفته چهار بار ارزیابی شد. علاوه بر این، عکسهای بالینی، میکروسکوپ کانفوکال بازتابی (RCM) و رنگآمیزی هماتوکسیلین و ائوزین (HE) برای ارزیابی ویژگیهای پاتولوژیک هر بیمار قبل و بعد از درمان استفاده شد. ضایعات پوستی پسوریازیس بیماران پس از اوزون درمانی با روش سالین DIV ( هاوارد رابینس) به طور قابل توجهی بهبود یافت.
بهبود بالینی و بافت شناسی در بیماران مشهود بود (شکل ۱a و b). کاهش واضحی از اریتم التهابی و پوستهها در عکسهای بالینی نشان داده شده است (شکل ۱a). بافت شناسی و تصاویر RCM نشان داد که اپیدرم به طور قابل توجهی نازک تر است و سلول های التهابی نفوذی پس از ۱۴ روز درمان با اوزون نسبت به قبل از درمان کاهش یافته است (شکل ۱b-d). به همین ترتیب، نمرات PASI پس از درمان ۱۴ روزه در مقایسه با خطوط پایه به طور قابل توجهی کاهش یافت (شکل ۱e). به منظور بررسی مکانیسمهای بالقوه اثر اوزون بر پسوریازیس، ما سطح بیان سیتوکینهای مرتبط با پسوریازیس و فاکتورهای رونویسی را در سلولهای CD4 + T از خون محیطی بیماران با استفاده از PCR زمان واقعی کمی (qPCR) ارزیابی کردیم. سطح بیان IL-17a، IL-6، TNF-a، فاکتور رشد تبدیل کننده (TGF)-~، IFN-y و NF-KB پس از درمان با اوزون در مقایسه با قبل از درمان کاهش یافت (شکل ۱f).
سطح بیان IL-17f و گیرنده هسته ای تنها c (RORc) مربوط به فاکتور رونویسی اختصاصی سلول Th17 پس از درمان با اوزون کاهش یافت، اما این کاهش هیچ آمار معناداری نداشت (شکل ۱f). بیان IL-10 پس از درمان با اوزون افزایش یافت، اما مقدار آن قابل توجه نبود. این نتایج با اثربخشی بالینی مطابقت داشت. روی هم رفته، نتایج ما نشان میدهد که درمان موضعی اوزون میتواند با مهار فرآیندهای التهابی، وضعیت ضایعات پوستی پسوریازیس را در بیماران بهبود بخشد.
Title
Subtitle
شکل ۱. درمان موضعی اوزون باعث بهبود شرایط پاتولوژیک ضایعات پوستی پسوریازیس می شود. (الف) عکس های بالینی ضایعه پوستی پسوریازیس در روزهای ۰ (DO) و ۱۴ (D 14) با اوزون تراپی. (ب) رنگ آمیزی HE ضایعه پوستی پسوریازیس قبل و بعد از درمان. (ج) ارزیابی تصاویر RCM که لایههای اسکن ۲۵ و SOth را قبل و بعد از درمان نشان میدهند. (د) تجزیه و تحلیل آماری لایههای جاروب عمودی از تصاویر کمی RCM برای ارزیابی ضخامت اپیدرم. (ه) امتیازات PASI برای همه شرکت کنندگان. (و) PCR کمی برای تشخیص سطوح بیان سیتوکین ها و فاکتورهای رونویسی در سلول های CD4+T از خون محیطی بیماران پسوریازیس قبل و بعد از درمان. توجه:
بدون آمار معنادار = *=P < 0.05; ** = P < 0.01; *** = P < 0.001; NS.
مهار فنوتیپ های شبه پسوریازیس ناشی از IMQ با درمان موضعی اوزون
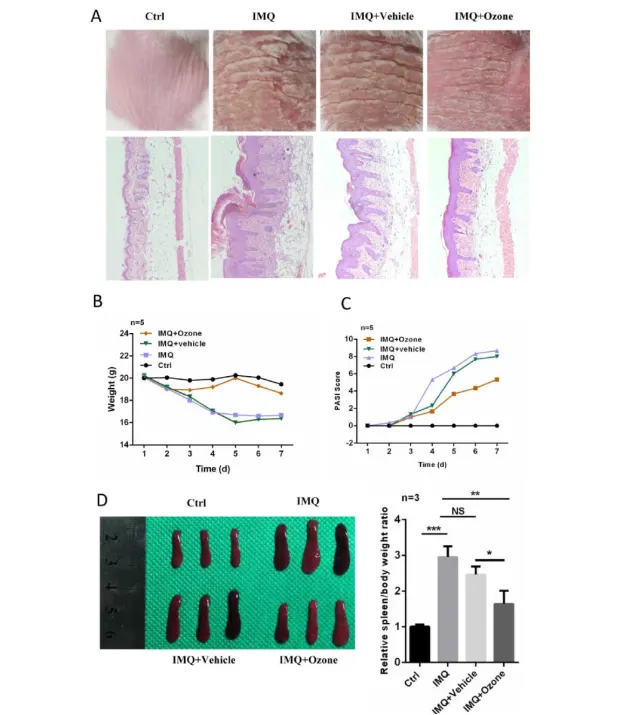
به منظور ارزیابی بیشتر اثربخشی درمانی اوزون موضعی بر پسوریازیس، از IMQ برای القای ضایعات پسوریازیس مانند در پوست پشتی انسان های BALB/c استفاده کردیم [۲۸]. استفاده روزانه از اوزون موضعی منجر به مهار قابل توجهی از ضایعات پسوریازیس مانند ناشی از IMQ در مقایسه با گروه درمان با وسیله نقلیه (آب + روغن پایه) شد (شکل ۲a). درمان موضعی اوزون از کاهش وزن ناشی از IMQ جلوگیری کرد (شکل ۲b) و نمرات PASI (شکل ۲c) را در انسان های پسوریازیس ناشی از IMQ بهبود بخشید. مطالعات قبلی [۶] نشان داده اند که IMQ می تواند باعث بزرگ شدن طحال در این مدل انسان شود. ما دریافتیم که درمان موضعی اوزون منجر به مهار قابل توجهی از افزایش نسبت طحال به وزن بدن در مقایسه با گروههای بدون درمان یا درمان با وسیله نقلیه شد (شکل ۲d). این نتایج نشان میدهد که درمان موضعی اوزون میتواند فنوتیپهای پسوریازیس مانند ناشی از IMQ را در این مدل انسان مهار کند.
مهار التهاب شبه پسوریازیس ناشی از IMQ با درمان موضعی اوزون
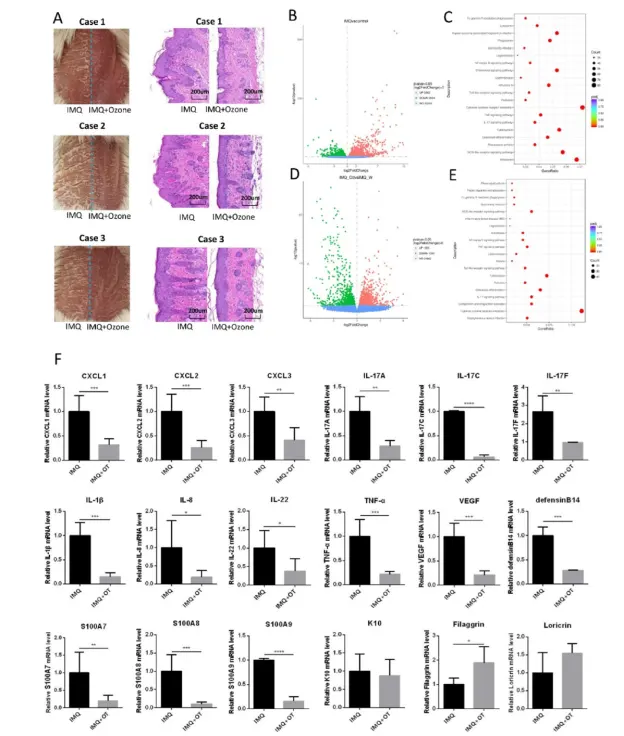
به منظور بررسی بیشتر مکانیسم زیربنای درمان با اوزون موضعی برای ضایعات پسوریازیس مانند ناشی از IMQ، سمت راست هر ضایعه را با اوزون موضعی درمان کردیم و سمت چپ ضایعه را بدون درمان به عنوان مقابل کنترل نگه داشتیم (شکل ۳a). ما رونوشتهای موجود در ضایعات پوستی را پس از درمان اوزون با توالییابی RNA (RNA-seq) تجزیه و تحلیل کردیم و با ضایعات پوستی بدون درمان مقایسه کردیم. ما دریافتیم که IMQ باعث افزایش بیان ۳۰۸۳ ژن و کاهش بیان ژن ۲۸S4 به ترتیب در مقایسه با شاهد شد (شکل ۳b).
تجزیه و تحلیل غنی سازی مسیر KEGG نشان داد که مسیرهای سیگنالینگ مرتبط با التهاب مانند NF-KB، TLR، TNF، و IL-17 به طور قابل توجهی در مدل انسان پسوریازیس ناشی از IMQ فعال شدند (شکل ۳c). در مقابل، درمان موضعی اوزون (سمت راست ضایعه) باعث افزایش سطح بیان ۱۰۲۳ ژن و کاهش سطح بیان ۱۰۰۰ ژن به ترتیب در مقایسه با ضایعات بدون درمان (سمت چپ ضایعات) شد (شکل ۳d). جالب توجه است که فعال سازی مسیرهای سیگنالینگ NF-KB، TLR، TNF و IL-17 ناشی از IMQ به طور قابل توجهی توسط کاربرد موضعی اوزون مهار شد (شکل ۳e). RT-PCR کمی بیشتر تأیید کرد که اوزون درمانی موضعی می تواند به طور قابل توجهی از بیان بسیاری از کموکاین ها، مانند لیگاند موتیف C-X-C (CXCL) 1، CXCL2، و CXCL3، و عوامل التهابی مرتبط با پسوریازیس، از جمله IL-17a، IL-17c، IL-17f، IL-1β ، IL-8، IL-22، TNF-α، فاکتور رشد اندوتلیال عروقی (VEGF)، دفنسین B14، S100A7، S100A8، و S100A9 جلوگیری کند (شکل ۳f). این نتایج نشان می دهد که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) موضعی می تواند ضایعات پسوریازیس را از طریق مهار فرآیندهای التهابی موضعی درمان کند.
بیشتر بخوانید: ایمنی و مزایای درمان درون وریدی مستقیم با اوزون (DIV)
مهار سیگنال دهی TLR2/NF-KB با درمان موضعی اوزون
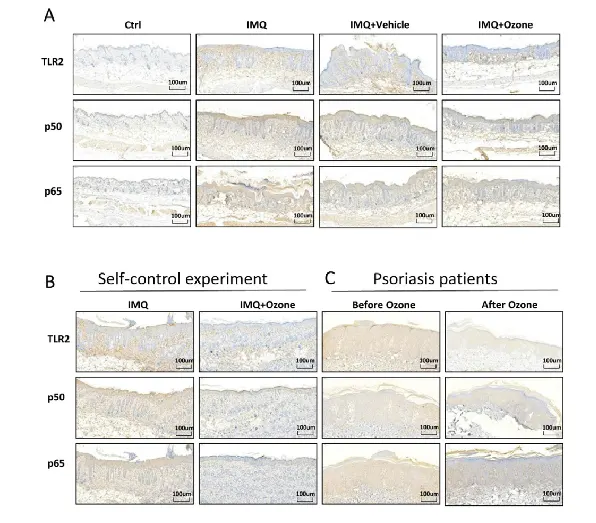
بسیاری از مطالعات نشان داده اند که مسیر سیگنالینگ TLR2/NF-KB باعث آزاد سازی عوامل التهابی متعدد در ضایعات پسوریازیس می شود و پاسخ التهابی ضایعات پسوریازیس را تشدید می کند. به منظور بررسی اینکه آیا اوزون موضعی میتواند سیگنالدهی TLR2/NF-KB را مهار کند، از ایمونوهیستوشیمی برای توصیف پروفایلهای بیان TLR2، PSO و P6S در ضایعات پسوریازیس مانند ناشی از IMQ و در بیماران استفاده کردیم. ما دریافتیم که درمان موضعی اوزون به طور قابل توجهی سطوح بیان TLR2، PSO و P65 ناشی از IMQ را در مدل انسان (شکل ۴a و b) و در بیماران مبتلا به پسوریازیس (شکل ۴c) کاهش داد. بنابراین، درمان موضعی اوزون می تواند به طور قابل توجهی سیگنال دهی TLR2/NF-KB را در ضایعات پوستی پسوریازیس مهار کند.
سرکوب تمایز Th 17 با درمان موضعی اوزون
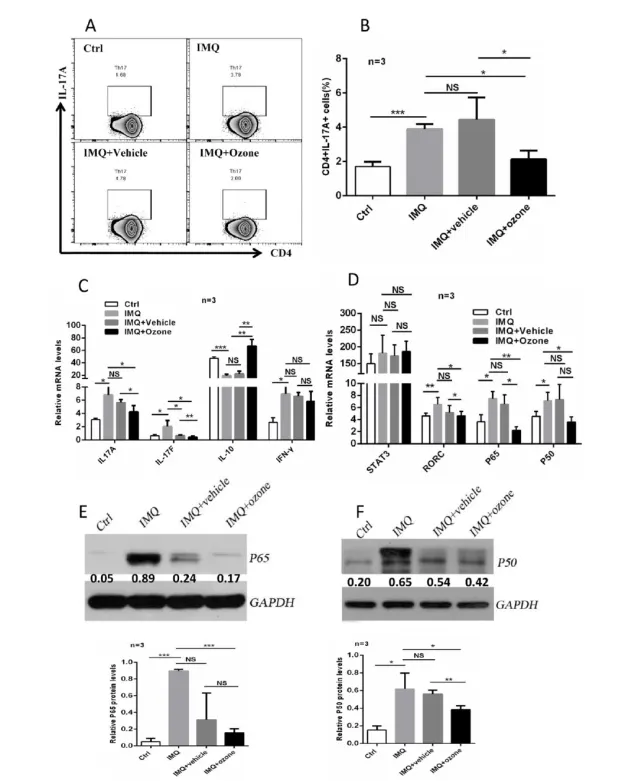
عدم تعادل ایمنی زیر مجموعه CD4+ T به عنوان یک عامل مهم در پاتوژنز پسوریازیس در نظر گرفته می شود. شواهد نشان داده است که نمرات PASI بیماران پسوریازیس ارتباط مثبتی با سطح IL-17 در سرم دارد و سلولهای Th17 زیرمجموعه T نفوذی اصلی در ضایعات پوستی پسوریازیس هستند [۲۹]. جای تعجب نیست که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) منجر به سرکوب قابل توجهی نسبت های قطبی سلول Th17 ناشی از IMQ شد (شکل ۵a و b). درمان با اوزون به طور قابل توجهی موجب جلوگیری بیان سطوح سیتوکین های مرتبط با لنفوسیت کمکی T (شکل ۵c)، از جمله IL-17a، IL-17f، IL-10، و IFN-y، و فاکتورهای رونویسی کلیدی (شکل ۵d)، مانند مبدل سیگنال و فعال کننده رونویسی (STAT) 3، RORc، و NF-KB گردید. در نهایت، ما بیان سطح PSO و P6S را در سلولهای CD4 + T طحال در بین چهار گروه با استفاده از وسترن بلات بررسی کردیم.
ما دریافتیم که درمان با اوزون به طور قابل توجهی بیان NF-KB را مهار می کند (شکل ۵e و f). بنابراین، اوزون درمانی موضعی ممکن است فعال سازی مسیرهای سیگنالینگ RORc و NF-KB ناشی از IMQ را برای تنظیم تمایز سلول های Th17 سرکوب کند. علاوه بر این، ما همچنین نسبت های متمایز سلول های Thl، سلول های Th2 و سلول های T تنظیمی (Treg) را مورد ارزیابی قرار دادیم. هیچ اثر قابل توجهی بر سطح سلول های Thl و Th2 وجود ندارد. نسبت سلول های Treg اندکی افزایش یافت (شکل تکمیلی la-c). این دادهها نشان میدهند که اوزون ممکن است بر روی پسوریازیس عمدتاً با مهار فعالسازی و تکثیر سلولهای Th17 و بیان سایتوکاینهای مرتبط با آنها عمل کند.
Title
Subtitle
شکل ۲. درمان موضعی با اوزون به طور قابل توجهی ضایعات پسوریازیس مانند ناشی از IMQ را در پوست انسان مهار می کند. انسان ها به طور تصادفی به چهار گروه Ctrl، IMQ ، IMQ + خودرو و IMQ+Ozone تقسیم شدند. (الف) ضایعات پوستی و ویژگی های بافتی در گروه های مختلف درمانی. (ب) تغییرات وزن بدن و (ج) امتیازات PASI برای انسانهای گروههای درمانی مختلف. (د) نسبت طحال و طحال به وزن بدن در گروه های مختلف درمانی. توجه:*= P <0.05; ** = P < 0.01; *** = P < 0.001; NS = از نظر آماری معنی دار نیست.
Title
Subtitle
شکل ۳. درمان موضعی اوزون به طور قابل توجهی التهاب مشابه پسوریازیس ناشی از IMQ را مهار می کند. (الف) ضایعات شبه پسوریازیس بر روی پوست پشتی مانسانوش با استفاده از IMQ القا شد. کرم اوزون موضعی در سمت راست ضایعه استفاده شد اما در سمت چپ ضایعه استفاده نشد. (ب) تجزیه و تحلیل رونوشت T نشان می دهد که IMQ در مقایسه با پوست معمولی به ترتیب باعث افزایش تنظیم و کاهش سطح بیان ژن ۳۰۶۳ و ۲۸۵۴ در ضایعات می شود. (ج) غنی سازی مسیر سیگنالینگ KEGG تنظیم شده در گروه IMQ در مقابل گروه کنترل. (د) تجزیه و تحلیل رونوشت نشان می دهد که درمان با اوزون باعث افزایش تنظیم و کاهش سطح بیان ۱۲۰۳ و ۱۰۰۰ ژن به ترتیب در ضایعات در مقایسه با گروه القای IMQ در آزمایش خودکنترلی شد. (ه) غنیسازی مسیر سیگنالینگ KEGG تنظیمشده در گروه IMQ+Ozone در مقابل گروه IMQ. (و) اعتبارسنجی تغییرات در عوامل التهابی مختلف مرتبط با پسوریازیس با استفاده از qPCR. توجه:*= P < 0.05: ** = P < 0.01: *** = P <0.001: بدون معنی آماری NS=.
Title
Subtitle
شکل ۴. درمان موضعی اوزون به طور قابل توجهی سیگنال دهی TLR2/NF-KB را مهار می کند. (الف) سطوح بیان TLR2. PSO. و P65 در ضایعات پوستی از Ctrl، IMQ. IMQ + خودرو. و گروه های IMQ+اوزون با آنالیز ایمونوهیستوشیمی مورد بررسی قرار گرفتند. (ب) سطوح بیان TLR2. PSO. و P65 در ضایعات پوستی انسان خودکنترلی ناشی از IMQ و (ج) ضایعات پسوریازیس انسانی قبل و بعد از درمان با اوزون .
بحث
غلظت بالای اوزون می تواند باعث آسیب سلولی و همچنین منجر به بیماری های تنفسی، سردرد، تحریک پوست و غیره شود [۳۰-۳۲]. با این حال، غلظت های پایین اوزون در محدوده درمانی (10-80 میکروگرم بر میلی لیتر گاز) را می توان به طور موثر با ظرفیت آنتی اکسیدانی قوی بدن به منظور جلوگیری از اثرات سمی بر سلول ها استعمال نمود. چنین غلظتهایی از اوزون بهعنوان یک عامل استریلکننده، بهبود زخم، تنظیم ایمنی و انجام عملکردهای ضددرد مورد استفاده قرار گرفتهاند [۳۳]. اوزون می تواند به سرعت اکسیژن، گونه های اکسیژن فعال (ROS)، محصولات اکسیداسیون لیپید (LOPs) و آلدئیدها را در تماس با بافت پوست تولید کند. ROS به عنوان پیام رسان های کوتاه مدت عمل می کند و به سرعت ناپدید می شود. LOP ها می توانند از طریق عروق لنفاوی و مویرگ ها وارد گردش خون شوند و به عنوان پیام رسان های با اثر طولانی عمل کنند.
آلدئیدها با سیستئین و گلوتاتیون (GSH) ترکیب میشوند و یک ترکیب اضافی الفینی پایدار تشکیل میدهند که میتواند به سلولهای مختلف بدن انسان وارد شده و فاکتور هستهای اریتروئید ۲ مربوط به فاکتور ۲ (Nrf2) – عنصر پاسخ آنتیاکسیدانی (ARE) مسیر سیگنالینگ برای ظرفیت بهبود آنتیاکسیدانی را فعال کند[۳۳]. اوزون به دلیل ظرفیت آنتی اکسیدانی خود می تواند در بسیاری از بیماری های التهابی نقش درمانی داشته باشد. به عنوان مثال، اوزون درمانی با روش سالین DIV ( هاوارد رابینس) التهاب و آسیب اندومتر را در انسانهای صحرایی مبتلا به بیماری های التهابی لگن بهبود می بخشد [۳۴]. اوزون درمانی با روش سالین DIV ( هاوارد رابینس) موضعی بیان عوامل التهابی مانند پنتراکسین-۳ (PTX-3)، IL-1β و پروتئین واکنشی C با حساسیت بالا (Hs-CRP) را در بیماران پریودنتیت مهار می کند [۳۵].
ما نشان دادهایم که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) موضعی نه تنها میتواند استافیلوکوکوس اورئوس را در درماتیت آتوپیک از بین ببرد، بلکه میتواند با مهار بیان IL-4، التهاب را نیز مهار کند [۳۶، ۳۷]. تعداد فزاینده ای از شواهد نشان می دهد که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) ممکن است بتواند جایگزین یا کاهش استفاده بالینی آنتی بیوتیک ها و گلوکوکورتیکوئیدها شود و در نتیجه خطراتی مانند مقاومت آنتی بیوتیکی و عوارض جانبی ناشی از استفاده طولانی مدت از گلوکوکورتیکوئیدها را کاهش دهد.
Title
Subtitle
شکل ۵. درمان موضعی اوزون تمایز Th 17 را برای کاهش بیماری پسوریازیس سرکوب می کند. (الف) فلوسیتومتری برای تعیین نسبت سلول های Th 17 در طحال و غدد لنفاوی مانسان وش از چهار گروه. به عنوان مثال، Ctrl، IMQ. IMQ + خودرو. و IMQ+Ozone. (ب) تجزیه و تحلیل آماری نسبت سلول های Th 17 در میان گروه های مختلف. PCR کمی برای بررسی سطح بیان سیتوکینها (c) و فاکتورهای رونویسی (d) در سلولهای CD4+ T جدا شده از طحال و غدد لنفاوی انسان. وسترن بلات برای ارزیابی سطح بیان P65 (d) و PSO (e) در سلول های CD4 + T جدا شده از طحال انسان و غدد لنفاوی از چهار گروه. سطح بیان نسبی به سطوح GAPDH نرمال شد. توجه:
P <0.05; ** = P < 0.01; *** = P < 0.001; =*, NS = معنی آماری ندارد.
پسوریازیس یک بیماری التهابی پوستی مزمن عود کننده است. ما معتقدیم که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) می تواند پیشرفت پسوریازیس را با مهار پاسخ التهابی ضایعات پوستی کنترل کند. مطالعات نشان داده اند که روغن اوزون دار نه تنها اکسیژن فعال را به دست می دهد، بلکه مشتقات اوزون دار فعال درمانی را برای مدت طولانی حفظ می کند [۳۸]. مطالعات قبلی ما نشان داده است که روغن اوزون دار برای درمان پسوریازیس ولگاریس پایدار، با اثربخشی معادل گلوکوکورتیکوئیدهای با اثر متوسط، ایمن و مؤثر است [۳۹].
در این مطالعه، ما نشان دادیم که ضایعات پوستی پسوریازیس بیماران به طور قابل توجهی کاهش می یابد و نشانگرهای زیستی التهابی مانند IL-17a، IL-6، TNF-α، TGF-β و IFN-γ به طور قابل توجهی پس از درمان اوزون کاهش می یابند. ما همچنین نشان دادهایم که اوزونتراپی میتواند به طور قابلتوجهی مسیرهای مرتبط با التهاب، مانند NF-KB، TLR، TNF، و IL-17 را در یک مدل حیوانی پسوریازیس مهار کند. این داده ها بینشی در مورد مکانیسم های اساسی اثرات درمانی اوزون درمانی با روش سالین DIV ( هاوارد رابینس) بر ضایعات پسوریازیس ارائه می دهد.
مطالعات متعدد سطوح بالایی از TLRs را در ضایعات پسوریاتیک پیدا کرده اند [۴۰-۴۳]. TLR ها دسته بسیار مهمی از گیرنده های تشخیص الگو (PRR) هستند. پس از شناسایی PAMPها، مانند لیپوپلی ساکاریدها، پپتیدوگلیکان، محصولات ویروسی و اجزای هسته باکتریایی، TLRها مسیرهای سیگنال دهی پایین دستی را فعال می کنند تا با ترویج آزادسازی سیتوکین های پیش التهابی و شروع پاسخ های ایمنی خاص ۴۶، فعال سازی ذاتی ایمنی را القا کنند. افزایش غیرطبیعی PAMPs (مانند لیپوپلی ساکاریدها و پپتیدوگلیکان) در ضایعات پسوریازیس، مسیر سیگنالینگ NF-KB را فعال میکند و بیان سایتوکاینهای پیشالتهابی را تقویت میکند، که باعث ایجاد یک پاسخ التهابی قوی در پسوریازیس موضعی میشود [۴۷، ۴۸]. در این مطالعه، ما نشان دادیم که درمان با اوزون می تواند به طور قابل توجهی مسیر سیگنالینگ TLR2/NF-KB را در ضایعات پسوریازیس مهار کند و در نتیجه پاسخ التهابی موضعی پسوریازیس را کاهش دهد. چند توضیح بالقوه برای این امر وجود دارد. اول، اوزون درمانی می تواند تولید PAMPs را با مهار میکروارگانیسم های کلونیزه شده در سطح ضایعات کاهش دهد، که باعث کاهش فعال سازی مسیر TLR2/NF-KB می شود. دوم، فعال شدن سیستم آنتی اکسیدانی توسط اوزون مانند Nrf2-ARE در بدن می تواند پاسخ های التهابی با واسطه NF-KB را متضاد کند [۴۹، ۵۰]. سوم، اکسیژن تولید شده توسط اوزون درمانی می تواند محیط هیپوکسیک ضایعات پوستی پسوریازیس را بهبود بخشد و پاسخ های التهابی ناشی از هیپوکسی را مهار کند.
فعال شدن سلول های Th17 برای پاسخ التهابی ضایعات پسوریازیس ولگاریس امری بسیار مهم است [۵۱]. نتایج ما نشان میدهد که درمان با اوزون میتواند به طور قابلتوجهی افزایشهای ناشی از IMQ در تعداد و عملکرد فعال سلولهای Th17 را مهار کند. فعال سازی مسیر سیگنالینگ NF-KB می تواند باعث فعال شدن سلول های Th17 شود [۵۲].
بنابراین، سرکوب فعال شدن سلول های Th17 با واسطه اوزون احتمالاً به دلیل مهار مسیرهای NF-KB است. علاوه بر سلول های Th17، سایر سلول های ایمنی مانند Thl، Th2، سلول های دندریتیک (DCs)، سلول های کشنده طبیعی (NK) و ماکروفاژها نیز در پاسخ التهابی پسوریازیس نقش دارند [۵۳]. با این حال، نتایج ما نشان می دهد که درمان با اوزون تأثیر حداقلی بر این سلول ها دارد. بنابراین، اوزون احتمالاً تأثیر خاصی بر تنظیم سلولهای Th17 در طول درمان پسوریازیس دارد.
علاوه بر آب و روغن اوزون دار، اتوهمتراپی اوزون و تزریق حفره گاز اوزون / نقطه طب سوزنی نیز برای بهبود ظرفیت آنتی اکسیدانی بدن و تنظیم التهاب گزارش شده است [۵۴-۵۶]. اینکه آیا می توان از این درمان ها برای پسوریازیس استفاده کرد یا خیر، هنوز مشخص نشده است. همچنین می توان اوزون را در ترکیب با سایر عوامل به منظور کاهش عوارض جانبی و افزایش اثربخشی استفاده کرد. به عنوان مثال، تزریق ترکیبی داخل دیسکال و پری گانگلیونی اوزون پزشکی و استروئیدها دارای یک اثر تجمعی است که منجر به افزایش نتایج کلی در درمان درد ناشی از فتق دیسک می شود [۵۷]. اوزون تراپی موضعی عوارض جانبی کمی مانند درد تحریک کننده دارد و به ندرت عوارض جانبی سیستمیک ایجاد می کند. محدودیت هایی در این مطالعه وجود دارد. به عنوان مثال، هیچ داده ای در مورد اثربخشی طولانی مدت درمان یا تأثیر آن بر میزان عود وجود ندارد. این سوال که آیا درمان اوزون نقش تنظیمی در تکثیر و تمایز کراتینوسیت ها و در اتساع عروق پسوریازیس ایفا می کند هنوز پاسخی ندارد.
خلاصه
اوزون درمانی با روش سالین DIV ( هاوارد رابینس) با روش سالین DIV ( هاوارد رابینس) به طور گسترده به منظور درمان بسیاری از بیماری های پوستی از جمله عفونت ها، درماتوز آلرژیک و زخم های پوستی استفاده شده است. با این حال، اثربخشی آن در درمان پسوریازیس نامشخص است. در این مطالعه، ما اثربخشی بالینی و مکانیسمهای مولکولی زیربنایی اوزون درمانی با روش سالین DIV ( هاوارد رابینس) را در خصوص پسوریازیس بررسی کردیم. ما دریافتیم که درمان موضعی با اوزون به طور قابلتوجهی درجات ناحیه پسوریازیس و شاخص شدت (PASI) و بیان سایتوکاینهای مرتبط با پسوریازیس را در سلولهای CD4+ T خون محیطی کاهش میدهد. در مدل انسان پسوریازیس ناشی از IMQ، درمان موضعی اوزون به طور قابل توجهی از تشکیل ضایعات پسوریازیس مانند ناشی از IMQ و بروز عوامل التهابی مرتبط با پسوریازیس جلوگیری کرد.
توالییابی با توان بالا تأیید کرد که فعالسازی مسیر سیگنالینگ گیرنده شبه ۲ (TLR2)/فاکتور هستهای-KB (NF-KB) ناشی از IMQ به طور قابلتوجهی در ضایعات شبه پسوریازیس پس از درمان موضعی اوزون سرکوب شد. علاوه بر این، فعال شدن سلول های T helper (Th) 17 طحال در مدل انسان مسدود شد. این مورد با کاهش سیتوکین ها و مسیرهای NF-KB در درمان موضعی اوزون همراه بود. اوزون درمانی با روش سالین DIV ( هاوارد رابینس) می تواند واکنش های التهابی موضعی و فعال شدن سلول های Th 17 در پسوریازیس را با مهار مسیر NF-KB کاهش دهد. نتایج ما نشان می دهد که اوزون درمانی با روش سالین DIV ( هاوارد رابینس) در درمان پسوریازیس موثر است. ما ارزیابی های بیشتری را برای کاربردهای بالینی آن توصیه می کنیم.